
文章解读 | 转录因子ATF4在肝纤维化中的作用机制研究
2025年1月9日,Nature communications在线发表了浙江大学冯宇雄、德克萨斯大学李文博、西湖大学You Jia作为共同通讯作者的研究成果,该研究深入探讨了内质网应激反应中的关键转录因子ATF4在肝纤维化中的作用机制。与以往认为ATF4主要在内质网应激(ER stress)中发挥作用不同,该研究发现,在致纤维化条件作用下,ATF4通过一种与应激无关的表观遗传程序促进肝星状细胞(HSC)的激活,进而驱动肝纤维化的发生。该研究揭示了ATF4在肝纤维化中的新功能,并提出了针对ATF4的潜在治疗策略。
肝纤维化是多种肝损伤的常见病理结果,主要特征是细胞外基质过度积累。肝代谢综合征(如非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH))、酒精滥用和病毒性肝炎等是导致肝纤维化的主要原因。肝星状细胞(HSC)是响应肝损伤的主要纤维化细胞类型。
ATF4通常被认为是内质网应激反应中的主要转录因子,调控未折叠蛋白反应(UPR)基因。然而,本研究发现在纤维化条件下,ATF4主要通过促进上皮-间质转化(EMT)基因的转录来促进肝纤维化,而并非通过经典的UPR途径。转化生长因子β (TGFβ)是肝星状细胞激活的关键信号,该研究发现TGFβ重置ATF4的调控程序,使其特异性地激活促纤维化的EMT基因。染色质免疫沉淀测序(ChIP-seq)揭示ATF4通过结合特定的基因组位点,尤其是增强子区域来调控肝纤维化相关基因的表达。在TGFβ刺激下,ATF4与H3K27ac标记的活跃增强子区域共定位,调控EMT相关基因的转录。该研究还发现,一种针对ATF4翻译的小分子抑制剂ISRIB可以有效缓解肝纤维化,提示了该通路在肝纤维化治疗中的潜力。最后,研究通过对人肝脏数据的分析,证实了肝星状细胞ATF4表达与肝纤维化进展之间的强相关性:在肝硬化患者的肝脏样本中,肝星状细胞的ATF4表达水平显著升高,并且与肝纤维化程度呈正相关[1]。

图1:特异性敲除肝脏星状细胞内的ATF4基因可降低大鼠肝纤维化
原文链接地址:
https://doi.org/10.1038/s41467-024-55738-1
关于肝纤维化体外模型
科途医学可以提供以下4类肝纤维化体外模型用于肝纤维化研究。
大鼠肝星状细胞分离和活化模型
肝星形细胞(Hepatic stellate cells, HSC)具有生成细胞外基质,分泌细胞因子以及收缩等多种功能,在肝纤维化的发生、发展中起核心作用,是目前肝纤维化实验研究的热点。
大鼠肝星状细胞分离是大鼠肝脏分离,用胶原酶和链霉蛋白酶E进行原位灌注,消化肝脏组织。灌注完成后,将肝脏剪碎,制备细胞悬液通过梯度离心,分离肝星状细胞。通过免疫细胞化学染色检测结蛋白(Desmin)或α-平滑肌肌动蛋白(α-SMA),细胞纯度可达90%以上。
分离后的肝脏星状细胞,使用10ng/mL的TGF-β1处理HSC细胞,24小时后细胞形态拉伸,伪足增多,呈现活化状态。HSC活化的时候,细胞收缩性增强,细胞外基质(ECM)分泌增加,α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、波形蛋白(Vimentin)表达增加。
肝脏星状细胞系活化模型
肝星状细胞系是通过将原代肝星状细胞进行基因改造(如引入SV40大T抗原)实现永生化的细胞系。这些细胞系保留了原代细胞的生物学特性,包括细胞因子分泌、细胞外基质代谢和对纤维化刺激的响应。
人肝星状细胞系LX-2保留了肝星状细胞的关键功能,如细胞因子信号转导、视黄醇代谢和纤维化相关基因表达。大鼠星状细胞系HSC-T6具有典型的肝星状细胞功能,包括对视黄醇的代谢和对纤维化刺激的响应。
肝星状细胞系可以开展丰富的检测方法建立和基因修饰,用于靶点筛选,纤维化机制研究等。TGF-β1可以诱导肝星状细胞系的活化,增加细胞外基质(COL1A1等)分泌增加,α-SMA、Vimentin表达增加。通过检测α-SMA等标志物,建立检测方法。
肝实质细胞EMT模型
肝细胞EMT是肝纤维化的重要病理机制之一。在慢性肝损伤的微环境下,肝细胞通过EMT转化为具有纤维生成能力的肌成纤维细胞,分泌大量细胞外基质(ECM)和胶原蛋白,导致肝脏纤维化。研究表明,EMT不仅涉及肝细胞,还可能包括胆管上皮细胞和肝星状细胞(HSC),这些细胞的EMT共同促进了肝纤维化的进展。EMT是一个动态且可逆的过程。在某些条件下,纤维化的肌成纤维细胞可以重新转化为肝细胞,这一过程称为间质-上皮转化(MET)。通过调控EMT和MET的平衡,有望实现肝纤维化的逆转。
通过再2D或者3D条件下加入诱导纤维化的因子。TGF-β1是诱导肝细胞上皮-间质转化(EMT)的关键细胞因子,通过激活Smad信号通路,促进肝细胞表达间质标志物(如α-SMA、N-cadherin),同时抑制上皮标志物(如E-cadherin)的表达。
将肝细胞与肝星状细胞(HSC)或肝窦内皮细胞共培养,能够模拟肝纤维化的微环境。研究表明,这种共培养模型可以显著增强肝细胞EMT的诱导效果,并有助于研究细胞间相互作用对纤维化的影响。
3D细胞模型通过模拟肝脏的细胞多样性和结构特征,为研究肝纤维化提供了更具生理相关性的平台。例如,利用3D培养技术构建的肝纤维化模型能够更好地模拟肝细胞EMT过程,增强对药物测试和疾病建模的能力。
肝纤维化类器官重构模型
传统二维(2D)体外细胞模型无法准确复制人体肝脏的复杂结构和细胞间相互作用,导致临床疗效不佳以及药物发现过程中的诸多挑战。类器官技术为研究肝纤维化提供了更稳定且更具生理相关性的模型。这些类器官能够模拟肝脏的细胞多样性和结构特征,从而增强药物测试和疾病建模的能力。但是现有的肝脏类器官缺乏血管结构、免疫反应和微生物群相互作用等关键特征,限制了它们在完全体现肝纤维化进展过程中肝脏动态变化方面的有效性。通过整合患者特异性细胞,增强肝脏类器官的复杂性,建立肝脏微生理模型,可能有助于推动针对慢性肝病治疗的个性化医疗方法[2-4]。
研究表明,通过使用硫代乙酰胺(Thioacetamide, TAA)处理类器官,可以有效诱导肝纤维化。TAA处理后,类器官中α-平滑肌肌动蛋白(α-SMA)和胶原蛋白I(COL1A1)的表达显著增加,表明肝星状细胞的活化和细胞外基质的沉积。此外,TAA处理的类器官还表现出肝细胞和LSEC标记物的减少,以及巨噬细胞和HSC标记物的增加[5]。

图2:肝脏微生理模型示意图
关于肝纤维化动物模型
科途医学可以提供2种实验动物模型用于肝纤维化研究。
CCl₄ 诱导的肝纤维化模型
CCl₄(四氯化碳)诱导的肝纤维化模型是研究肝纤维化发病机制和评估抗纤维化药物效果的常用动物模型。CCl₄通过产生自由基损伤肝细胞,导致肝脏炎症和纤维化。
BDL诱导的肝纤维化模型
胆管结扎(Bile Duct Ligation, BDL)是一种常用的动物模型,用于研究胆汁淤积性肝病和肝纤维化的发病机制。通过结扎胆管,阻断胆汁流出,导致胆汁在肝脏内积累,引发炎症和纤维化。
关于肺纤维化动物模型
科途医学可以提供以下肺纤维化动物模型用于相关研究:博来霉素(Bleomycin)诱发的肺纤维化模型是研究肺纤维化发病机制和评估抗纤维化药物效果的常用动物模型。博来霉素通过引起肺部炎症和损伤,最终导致肺纤维化。
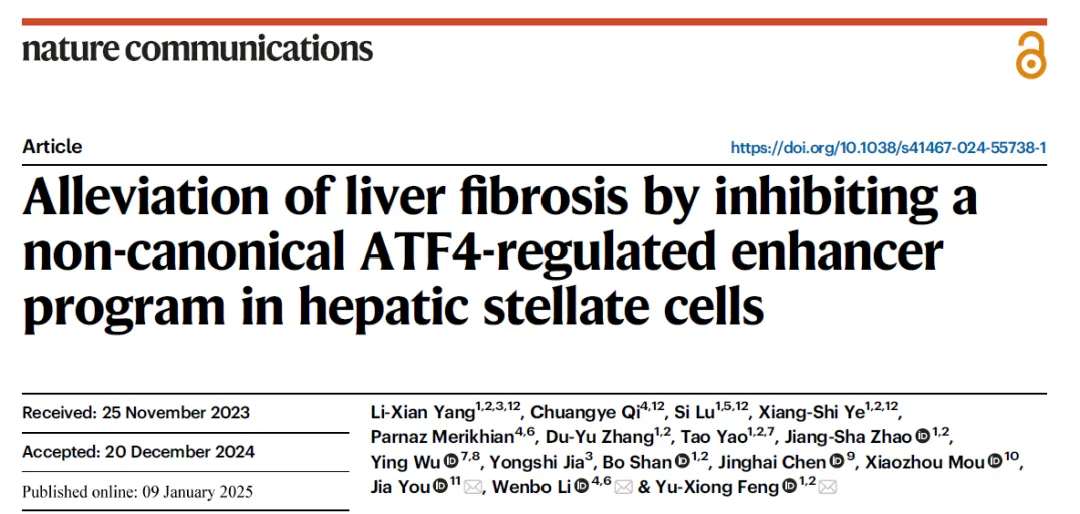
科途医学可以提供的其他动物模型
Tumor Models
肿瘤模型及药效评价服务
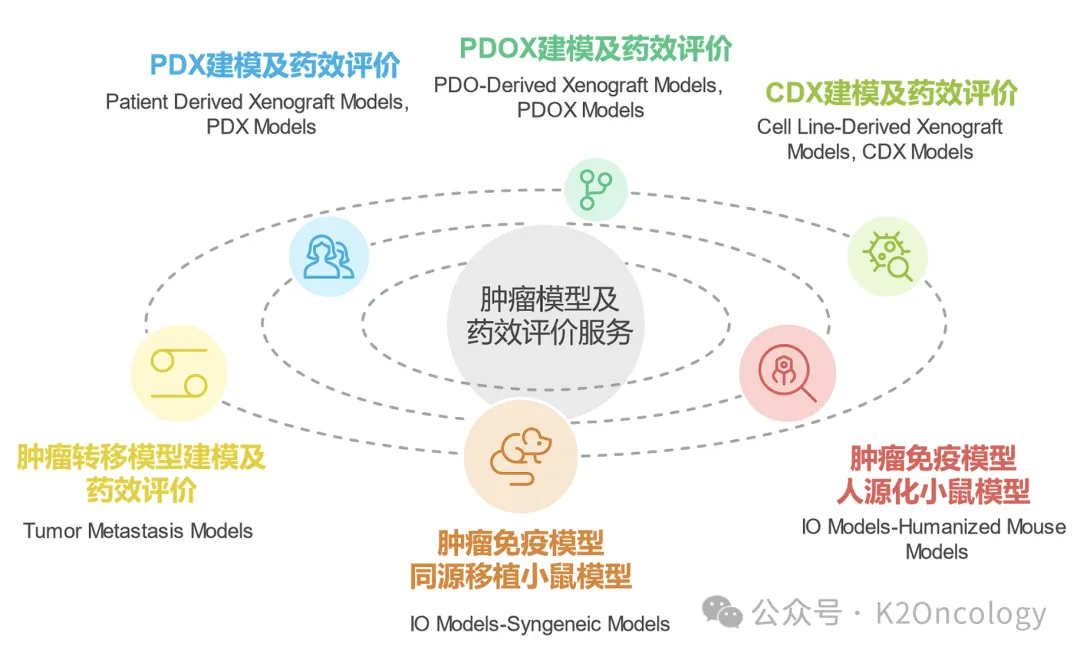
Other Disease Models
非肿瘤动物模型建模及药效评价
访问以下链接了解更多详情:
参考文献:
1. Yang LX, Qi C, Lu S, Ye XS, Merikhian P, Zhang DY, Yao T, Zhao JS, Wu Y, Jia Y, Shan B, Chen J, Mou X, You J, Li W, Feng YX. Alleviation of liver fibrosis by inhibiting a non-canonical ATF4-regulated enhancer program in hepatic stellate cells. Nat Commun. 2025 Jan 9;16(1):524. doi: 10.1038/s41467-024-55738-1. PMID: 39789010; PMCID: PMC11718104.
2. Yoon Y, Gong SC, Kim MY, Baik SK, Hong JE, Rhee KJ, Ryu H, Eom YW. Generation of Fibrotic Liver Organoids Using Hepatocytes, Primary Liver Sinusoidal Endothelial Cells, Hepatic Stellate Cells, and Macrophages. Cells. 2023 Oct 24;12(21):2514. doi: 10.3390/cells12212514. PMID: 37947592; PMCID: PMC10647544.
3. Guan Y, Enejder A, Wang M, Fang Z, Cui L, Chen SY, Wang J, Tan Y, Wu M, Chen X, Johansson PK, Osman I, Kunimoto K, Russo P, Heilshorn SC, Peltz G. A human multi-lineage hepatic organoid model for liver fibrosis. Nat Commun. 2021 Oct 22;12(1):6138. doi: 10.1038/s41467-021-26410-9. PMID: 34686668; PMCID: PMC8536785.
4. Navik U, Singh SK, Khurana A, Weiskirchen R. Revolutionizing liver fibrosis research: the promise of 3D organoid models in understanding and treating chronic liver disease. Expert Rev Gastroenterol Hepatol. 2025 Jan 20:1-6. doi: 10.1080/17474124.2025.2455581. Epub ahead of print. PMID: 39829275.
5. Yoon Y, Gong SC, Kim MY, Baik SK, Hong JE, Rhee KJ, Ryu H, Eom YW. Generation of Fibrotic Liver Organoids Using Hepatocytes, Primary Liver Sinusoidal Endothelial Cells, Hepatic Stellate Cells, and Macrophages. Cells. 2023 Oct 24;12(21):2514. doi: 10.3390/cells12212514. PMID: 37947592; PMCID: PMC10647544.
关于科途医学
科途医学是一家专注于类器官培养全流程产品、类器官建模服务、类器官疾病模型库建设、临床前药物发现、转化医学CRO服务的高科技公司,可提供类器官一站式解决方案。基于分泌蛋白质组学筛选技术,公司已经建立了30多种组织的类器官培养方法。产品包括EHSgel 基质胶、多种类器官培养基、类器官相关细胞因子、组织消化酶解液、类器官分离回收液、类器官冻存液等。我们致力于提供高质量、更可靠的类器官产品,助力客户科学研究的进展,欢迎您来电咨询。

使用科途医学类器官产品或模型发表的科研文献列表(部分)

订购及业务咨询:info@K2Oncology.com
技术服务咨询:TechSupport@k2oncology.com
联系电话:010-56538985, 13371633638(微信同步), 17778038351
网址:www.K2Oncology.com
地址:
●北京市北京经济技术开发区经海五路88号三区3号楼5层101
●浙江省湖州市红丰路1366号6幢10楼1001室
●河北省廊坊市固安县新兴园肽谷生物医药加速器产业园1号楼A1-1-4室



