
客户文章解读 | 乳腺癌类器官模型用于乳腺癌干细胞相关治疗靶点研究

2024年12月21日,Cancer Letters(IF 9.1)在线发表了来自兰州大学第二医院普外科关于乳腺癌的一项重要研究成果,该研究深入探讨了泛素-蛋白酶体系统在乳腺癌干细胞干性维持中的作用及其作为潜在治疗靶点的可能性。
乳腺癌干细胞是一群特殊的癌细胞,它们具有自我更新能力,产生构成肿瘤的其他细胞类型并引发肿瘤的复发和转移,被认为是乳腺癌治疗中耐药性产生的主要原因,因此抑制乳腺癌干细胞的干性对于彻底治愈乳腺癌至关重要。该研究发现,泛素连接酶UBE2T在乳腺癌中显著高表达,并通过与TRIM25相互作用,介导CBX6的泛素化和降解,从而促进SOX2和NANOG等干性相关转录因子的表达,最终增强乳腺癌干细胞的干性并促进肿瘤进展。此外,研究还发现戊二酰葡萄糖(PGG)能够靶向UBE2T的活性位点Cys86,抑制其泛素连接酶活性,从而抑制乳腺癌干细胞的干性和乳腺癌进展。
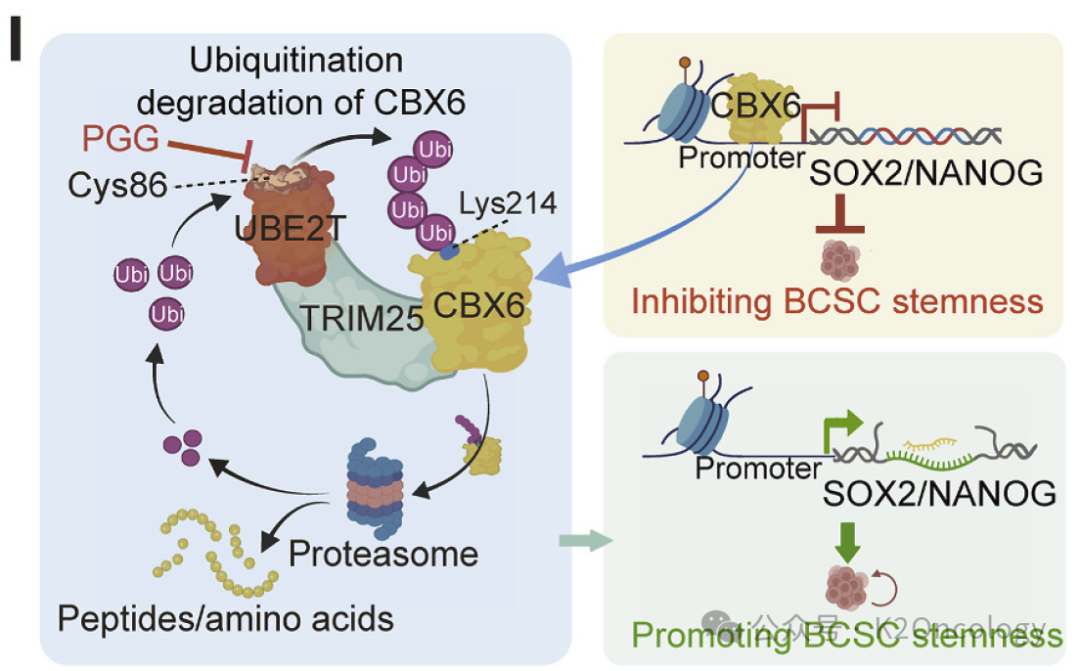
图1:UBE2依赖TRIM25对CBX6进行泛素化降解导致SOX2和NANOG表达增高从而保持乳腺癌干细胞干性
研究人员首先通过单细胞RNA测序,发现UBE2T在乳腺癌干细胞簇中富集(43.74%),接着,研究人员收集了来自兰州大学第二医院和甘肃省第三人民医院的乳腺癌患者的肿瘤组织样本,通过免疫组织化学(IHC)染色分析了UBE2T蛋白在肿瘤组织中的表达水平,并与正常乳腺组织进行了比较。结果显示,癌性乳腺组织中UBE2T蛋白水平显著高于正常组织,并且独立于雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2 (HER2)状态。研究将患者分为UBE2T高表达组和低表达组,通过Kaplan-Meier曲线和Log-rank检验分析了患者的无进展生存期(PFS)和总生存期(OS)。结果显示,高UBE2T表达的患者预后较差,10年无进展生存为55.95%,而低表达组为85.08%,10年总生存期分别为66.37%和88.54%。通过单变量和多变量Cox回归分析,证实UBE2T是一个独立的预后因素。这意味着UBE2T的表达水平可以独立于其他临床病理因素预测患者的生存结果。ROC曲线分析显示UBE2T对乳腺癌具有很高的鉴别能力(AUC=0.981),这表明UBE2T表达可以有效地区分乳腺癌和正常组织,多数据集验证还使用了来自TCGA和GEO数据库的多个乳腺癌数据集,在不同的乳腺癌亚型中验证了上述趋势:无论乳腺癌亚型如何,高UBE2T表达都与较差的预后相关。
研究分析了TCGA和METABRIC数据库,发现UBE2T基因在乳腺癌中具有高扩增率,并且与mRNA干性指数(mRNAsi)呈正相关。总的来说,通过对临床样本的分析、生存期分析、多数据集验证、独立预后因素分析和ROC曲线分析,该研究充分证明了UBE2T作为乳腺癌预后指标的价值。高UBE2T表达与患者的较差预后相关,这使得UBE2T成为一个潜在的预后生物标志物,可用于识别高风险乳腺癌患者。
UBE2T通过SOX2和NANOG调节乳腺癌干细胞的干性
在细胞水平,UBE2T敲除降低了MDA-MB-231和MCF-7细胞的成球能力,并减少了CD44highCD24low干细胞样细胞的比例。同时,研究人员使用乳腺癌类器官模型和基因工程小鼠模型,包括MMTV-PyMT-CRE(PC)和UBE2T条件性敲除PC小鼠(UPC)证明敲除UBE2T可以显著抑制肿瘤的发生和乳腺导管增殖,减少肿瘤负荷,降低肺转移率,并延长UPC小鼠的生存期,UBE2T的缺失导致基底样(K14+)细胞显著减少,这些细胞与乳腺上皮干细胞样特性相关。功能性分析显示,UBE2T敲除后,细胞增殖、集落形成、迁移和肿瘤发生能力显著降低。这进一步证实了UBE2T在乳腺癌发生和发展中的重要作用。同时,通过使用来源于这些小鼠肿瘤的类器官模型,进一步证实了UBE2T对肿瘤细胞干性的影响。UBE2T的缺失诱导了类器官中分化和增殖标记物的定位和表达的一致性降低改变,类器官生长速度减缓,侵袭减弱,CD44highCD24low干细胞样细胞的比例减少。
随后,该研究又证实UBE2T是通过SOX2和NANOG调节乳腺癌干细胞的干性:UBE2T的敲除下调了MYC、SOX2和NANOG的表达。沉默SOX2或NANOG导致肿瘤球形成减少和CD44high/CD24low细胞比例改变,表明它们是UBE2T驱动的乳腺癌干细胞干性的主要介质。患者组织和蛋白质组学数据显示,升高的UBE2T水平与SOX2和NANOG表达增加相关。双荧光素酶报告基因分析表明,UBE2T过表达增强了SOX2和NANOG启动子的活性。
UBE2T通过TRIM25对CBX6进行泛素化降解导致SOX2和NANOG表达增高
CBX6是一种已知的肿瘤抑制因子,它可以抑制SOX2和NANOG等干细胞转录因子的表达。蛋白质组学分析显示,与对照组相比,UBE2T敲除组中CBX6的表达显著增加,表明CBX6可能是UBE2T的底物,这意味着UBE2T可以通过泛素化作用标记CBX6,使其被蛋白酶体降解。CBX6结合SOX2和NANOG的启动子,调节其启动子活性。CBX6敲除逆转了UBE2T对SOX2和NANOG的影响,增强了乳腺癌细胞系的肿瘤球形成,并增加了CD44highCD24low细胞群。通过这种方式,UBE2T可以通过降低CBX6的水平来解除对SOX2和NANOG的抑制,进而促进乳腺癌干细胞的干性。
TRIM25是一种E3泛素连接酶,它与UBE2T和CBX6相互作用,形成三元复合物。TRIM25在促进UBE2T对CBX6的泛素化过程中至关重要。研究表明,TRIM25的存在能够增强UBE2T对CBX6的结合,并促进其K48链状泛素化,导致CBX6的降解,最终使SOX2和NANOG的表达升高。
戊二酰葡萄糖(PGG)是一种天然化合物,研究发现它可以特异性靶向UBE2T的Cys86位点,从而抑制其泛素酶活性。研究显示,PGG可以显著抑制人类和鼠类肿瘤类器官的增殖,并延长基因工程小鼠肿瘤移植模型的生存期。组织化学分析表明,PGG处理后,CBX6的表达升高,而SOX2和NANOG的表达降低。这表明PGG可以通过抑制UBE2T活性来对抗 BCSC的干性。UBE2T介导的CBX6泛素化依赖于Cys86残基。只有野生型UBE2T(UBE2Twt)才能恢复CBX6蛋白水平,并观察到SOX2和NANOG表达的伴随变化,而C86A突变体 (UBE2TC86A)则不能。UBE2Twt促进了人源乳腺癌类器官与UPC小鼠类器官的增殖,而UBE2TC86A没有影响。PGG(戊二酰葡萄糖) 是一种UBE2T的药理学抑制剂。PGG可以有效抑制UBE2T介导的CBX6泛素化,并减少人源乳腺癌类器官与UPC小鼠类器官中的CD44highCD24low细胞群体。PGG治疗可防止UBE2T诱导的CBX6降解,并降低SOX2、NANOG、Ki67和K14的表达。在GDA模型中,PGG治疗显著延长了小鼠的总体生存期。PGG可以抑制肿瘤生长和肿瘤负荷,并且用药后不会影响小鼠体重。PGG与化疗药物(如多西他赛、氟尿嘧啶和奥沙利铂)具有协同作用。
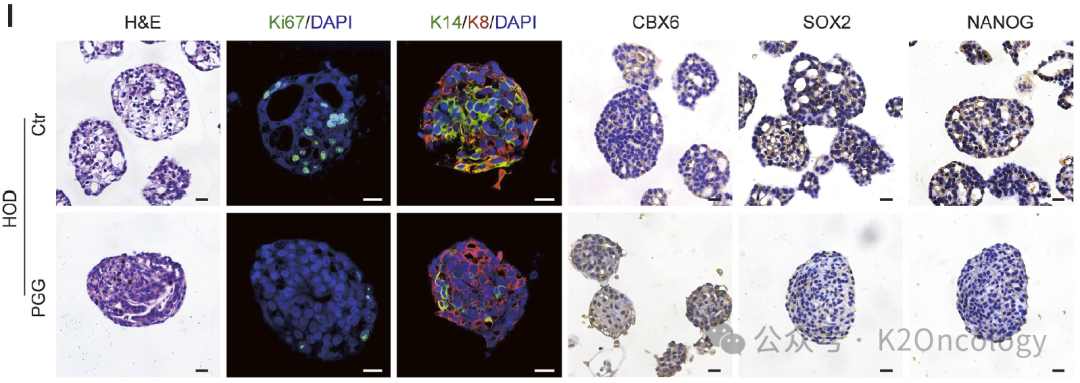
图2:戊二酰葡萄糖(PGG)处理后的人源乳腺癌类器官免疫组化与免疫荧光照片
本研究采用了多种实验技术,包括:
细胞培养和处理: 培养人乳腺癌细胞系(MDA-MB-231, MCF-7),并进行基因敲除、过表达、siRNA沉默等操作。
动物模型: 构建MMTV-PyMT/CRE/UBE2Tflox/flox小鼠模型,并进行肿瘤生长、转移等体内实验。建立GDA和CDX模型来研究药物疗效。
类器官模型:构建了人源乳腺癌类器官与UPC小鼠类器官,并进行了肿瘤生长、肿瘤侵袭等检测。
组织学和免疫组织化学分析: 通过H&E、IHC和IF染色来分析肿瘤组织。
分子生物学方法: 包括real-time PCR, western blotting, co-immunoprecipitation, in vivo ubiquitination assay, ChIP-qPCR, luciferase reporter assay等。
蛋白质组学和转录组学分析: 通过质谱分析和RNA测序来研究蛋白质和基因的表达变化。
单细胞RNA测序分析: 分析肿瘤单细胞数据,确定UBE2T在BCSC中的表达情况。
微尺度热泳动(MST): 用于量化蛋白质间的相互作用。
计算机辅助建模: 用于研究药物与UBE2T的相互作用。
总的来说,此项研究揭示了UBE2T通过TRIM25依赖性地降解CBX6,从而上调SOX2与NANOG的表达,促进乳腺癌干细胞的干性和乳腺癌进展。靶向UBE2T代表了一种有前景的乳腺癌治疗策略。

科途医学在此项研究中提供了人源乳腺癌类器官培养基。
原文链接地址:
https://doi.org/10.1016/j.canlet.2024.217409
关于科途医学
科途医学是一家专注于类器官培养全流程产品、类器官建模服务、类器官疾病模型库建设、临床前药物发现、转化医学CRO服务的高科技公司,可提供类器官一站式解决方案。基于分泌蛋白质组学筛选技术,公司已经建立了30多种组织的类器官培养方法。产品包括EHSgel 基质胶、多种类器官培养基、类器官相关细胞因子、组织消化酶解液、类器官分离回收液、类器官冻存液等。我们致力于提供高质量、更可靠的类器官产品,助力客户科学研究的进展,欢迎您来电咨询。

使用科途医学类器官产品或模型发表的科研文献列表(部分)

订购及业务咨询:info@K2Oncology.com
技术服务咨询:TechSupport@k2oncology.com
联系电话:010-56538985, 13371633638(微信同步), 17778038351
网址:www.K2Oncology.com
地址:
●北京市北京经济技术开发区经海五路88号三区3号楼5层101
●浙江省湖州市红丰路1366号6幢10楼1001室
●河北省廊坊市固安县新兴园肽谷生物医药加速器产业园1号楼A1-1-4室



