
慢病毒感染类器官建立稳定类器官株服务
类器官(Organoids)正成为一种非常有价值的研究工具,在组织病理学、生物标志物与遗传特征、药理功能水平上保留了大部分组织特征、具有较好的临床相关性(Clinical relevance)和模型创新性。
相对于动物模型(例如,PDX),类器官一个重要优势是可以更加便利的进行基因干预。本文介绍了基于慢病毒载体的基因修饰工具,包括在类器官中过表达特定基因,表达特定标签蛋白、基因沉默和基因编辑等。
利用慢病毒(Lentivirus)载体实现外源基因递送,对二维条件下培养的大多数哺乳动物细胞有效。相比之下,在类器官的培养条件下,细胞外基质水凝胶对外源病毒感染细胞造成干扰,类器官的干细胞特性,也不利于外源基因的表达。本文介绍了经过优化的慢病毒载体高效基因转导到类器官的实验方法。
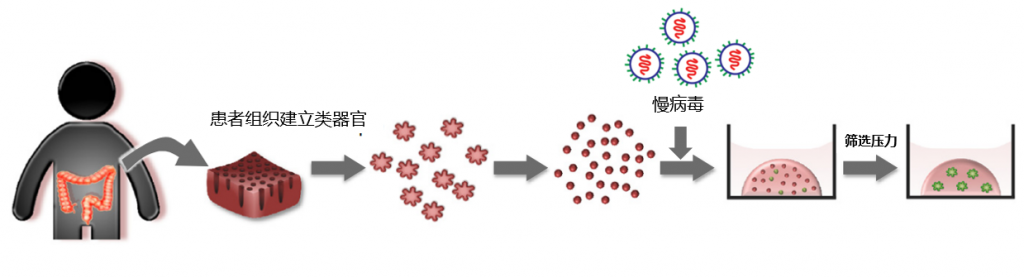
类器官培养扩增后,用蛋白酶分散成单个细胞,将这些单个细胞与慢病毒颗粒混合,病毒感染类器官细胞后,单细胞被接种在基质胶中,加入筛选压力继续培养(例如,嘌呤霉素),经过1-3周的筛选培养,得到稳定的基因修饰类器官株。(图1)
在某些情况下,慢病毒上设计表达荧光蛋白标签,在病毒感染类器官24-48小时后,单细胞经过无菌流式细胞分选,得到荧光表达的细胞群。阳性的细胞被接种在基质胶中,经过1-3周的继续培养,得到稳定的基因修饰类器官株。(图2)

外源基因表达强度,和启动子的表达强度有关。在具有干细胞特性的类器官中,可以使用CMV启动子,也可以优选EF1α启动子。

慢病毒稳转类器官优势:
1、高级别概念验证数据:类器官模型更好的模拟人体生理和病理的疾病模型,在类器官模型中开展基因干预,概念验证更具说服力;
2、类器官模型丰富:相对细胞系,货架式类器官模型库资源更加丰富,可以提供数量更多的模型可供基因修饰;
3、基因操作便利:可以在4-8周内完成稳定表达株的建立和鉴定,得到可传代且稳定表达的类器官模型群(Stable pool);
4、表型研究方法丰富:构建的类器官模型,可以开展增殖能力检测、药物敏感性测试、凋亡分析、细胞周期分析、体内动物实验(PDOX,类器官抑制瘤动物模型)和肿瘤免疫等功能试验和表型研究;
5、兼容多组学研究:经过基因修饰的类器官模型,可以利用基因组、转录组、蛋白组、表观遗传等多种组学工具开展机制研究。
应用案例1:在宫颈癌类器官中过表达HLA-A*11:01基因[1]
实验目的:在HPV16+宫颈癌类器官中过表达HLA-A*11:01基因,用于测试识别HLA-A*11:01限制性HPV16 E6/E7 表位的TCR-T细胞对宫颈癌细胞的杀伤。
研究概述:在肿瘤细胞上,发现两种新型的HPV16的HLA-A*11:01限制性T细胞表位。研究者从 11 名健康供体中分离出 TTL 和 IVC 特异性 TCR。绘制了参与TCR-pMHC相互作用的关键TTL和IVC残基。使用具有高功能亲和力的TTL和IVC特异性TCRs产生TCR工程化的T细胞,识别并杀死了HPV16+患者来源的类器官。
实验步骤:1. 构建HLA-A*11:01-P2A-GFP 慢病毒质粒。2. 在293FT细胞中,共转核心质粒和病毒包装质粒,收取病毒上清,浓缩病毒,测试病毒滴度。3. 在细胞系中验证靶基因表达提升能力。4. 感染类器官单细胞。5. 抗性筛选。6. 稳定株建立鉴定。(图4)
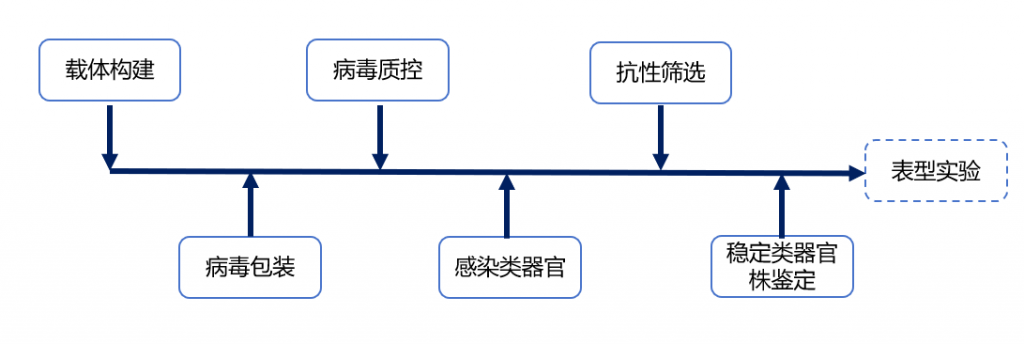
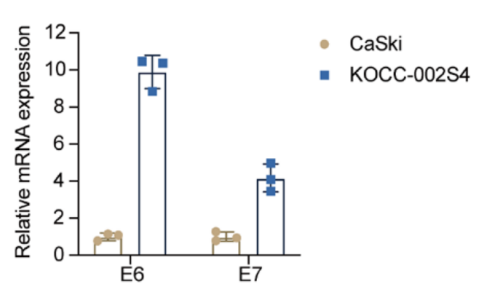

图4: 在HPV16+宫颈癌类器官中过表达外源基因
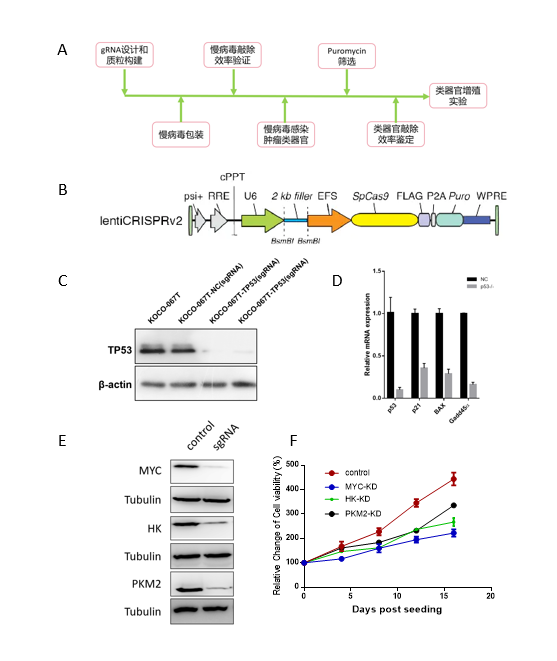
应用案例2:基因编辑修饰肿瘤类器官模型用于靶点验证
实验目的:运用基因编辑技术,在肿瘤类器官中敲除靶基因,并验证其对肿瘤类器官增殖的影响。
研究概述:本研究通过组学工具鉴定的一组肿瘤靶点,通过类器官模型进行靶点验证。
实验过程概述:
1. 针对每个靶基因设计5条gRNA序列,克隆到lentiCRISPRv2载体上,该载体包含由U6启动子启动的gRNA表达,EFS启动子启动的SpCa9基因和抗性基因(puro)。
2. 表达质粒、包装质粒和G糖蛋白质粒按照一定比例,转染到293FT细胞中,共转核心质粒和病毒包装质粒,收取病毒上清,浓缩病毒,测试病毒滴度。
3. 在293T细胞系中验证靶基因敲除效率。
4. 感染肿瘤类器官单细胞悬液。
5. 抗性筛选。
6. 稳定株建立和基因敲除效率鉴定。
7. 靶基因敲除对类器官增殖能力影响评价。
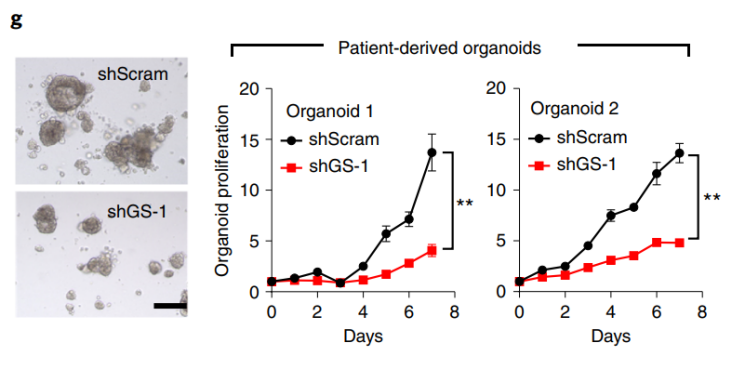
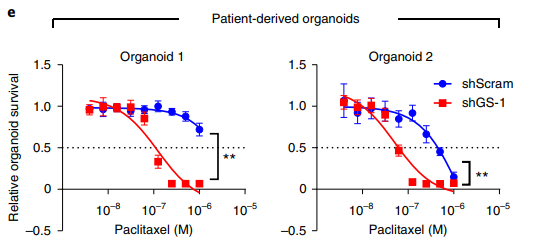
应用案例3:用慢病毒介导的shRNA干扰谷氨酰胺合成酶并比较非小细胞肺癌类器官增殖和对药物的敏感性[2]
实验目的:在非小细胞肺癌类器官中,干扰谷氨酰胺合成酶(glutamine synthetase, GS)后,评价GS对肿瘤表型的影响,以及对药物敏感性的变化。
研究概述:该研究揭示了谷氨酰胺合成酶(glutamine synthetase, GS)在肿瘤细胞中通过酶活性非依赖的方式活化APC/CCDC20复合物促进肿瘤细胞有丝分裂的新机制,为深入系统认识谷氨酰胺代谢在肿瘤细胞中的重要作用提供了新的视

[参考文献]
- Xiong C, et.al. Identification of novel HLA-A*11:01-restricted HPV16 E6/E7 epitopes and T-cell receptors for HPV-related cancer immunotherapy. J Immunother Cancer. 2022
- Zhao JS eal. Glutamine synthetase licenses APC/C-mediated mitotic progression to drive cell growth. Nat Metab. 2022
【联系我们 】
技术服务咨询:info@K2Oncology.com
客服电话:400-160-9699
网址:www.K2Oncology.com
地址:
●北京市北京经济技术开发区经海五路88号三区3号楼5层101
●浙江省湖州市红丰路1366号6幢10楼1001室
●河北省廊坊市固安县新兴园肽谷生物医药加速器产业园1号楼A1-1-4室



