
卵巢癌治疗新策略丨抑制GPX4可显著增加PARPi在BRCA 1缺失型卵巢癌细胞中诱导的铁死亡
铁死亡是一种不同于自噬、凋亡和坏死的新型细胞死亡方式,通过细胞铁过载和脂质过氧化启动。近年来,越来越多的研究探索铁死亡相关机制在卵巢癌中的作用。
铁死亡过程受铁代谢途径、脂质代谢途径、谷氨酰胺分解途径、系统xc-/谷胱甘肽过氧化物酶4(GPX4)途径等调控。其中,GPX4被认为是铁死亡发生的关键调节因子,并且涉及到多种疾病发病机制的研究。
2024年9月11日在氧化应激领域国际顶级期刊《Redox Biology》(IF:10.787)发表的论文“Targeting GPX4-mediated ferroptosis protection sensitizes BRCA1-deficient cancer cells to PARP inhibitors”发现了BRCA1缺陷肿瘤患者新的治疗靶点GPX4,为药物开发和临床治疗提供了重要方向,并且揭示了BRCA1通过调节铁死亡来发挥抗肿瘤功能的新机制。
本研究所用的卵巢癌类器官模型及相应类器官培养基均由科途医学提供。

文献导读:
BRCA1是卵巢癌和乳腺癌中最常发生突变的肿瘤抑制基因之一。
在这两种癌症中,大约20%~30%的患者携带有BRCA1突变。BRCA1的缺失引发同源重组(HR)修复缺陷,从而导致基因组不稳定和PARP抑制剂(PARPi)相关的合成致死性。
由于BRCA1突变携带者对PARPi的反应差于BRCA2突变患者,因此,如何在BRCA1突变患者中优化PARPi疗效成为了本研究的动力之一。
研究路线:
本研究采用多种方法开展,包括患者样本收集建立肿瘤类器官模型及PDX模型、表达载体的构建、细胞培养和转染、免疫共沉淀(IP)、免疫组化(IHC)染色、基因敲除(KO)细胞的建立、脂质过氧化物检测、邻位连接分析(PLA)、泛素化分析、质谱分析GPX4泛素化位点、细胞凋亡分析、细胞死亡和活力检测、克隆形成实验、实时定量PCR、亚细胞成分分离、无标签定量蛋白质组分析等
这些实验手段涵盖了从分子层面到动物模型的全面分析,为研究BRCA1在铁死亡中的作用提供了详实的实验依据。
研究结果:
研究结果发现BRCA1通过催化GPX4的K6连接多聚泛素化,并随后加速GPX4降解从而促进铁死亡敏感性。在96例卵巢癌标本中进行BRCA1与GPX4的IHC染色结果显示BRCA1与GPX4的表达呈明显的负相关性。BRCA1的缺失导致GPX4蛋白升高,在卵巢癌细胞中诱导铁死亡抗性,而GPX4的沉默表达显著抑制了BRCA1缺陷卵巢癌PDX小鼠瘤块的生长。研究者发现PARPi在卵巢癌细胞中触发铁死亡,抑制GPX4可显著增加PARPi诱导的BRCA 1缺陷卵巢癌细胞铁死亡。
GPX4抑制剂和PARPi的联合治疗在BRCA1缺陷的卵巢癌细胞、患者来源的卵巢癌类器官(PDO)和PDX小鼠中产生了协同的抗肿瘤效果。
因此该研究揭示了BRCA1通过调节铁死亡来发挥肿瘤抑制功能的新机制,并证明了GPX4作为BRCA1突变型癌症的治疗靶点的潜力。
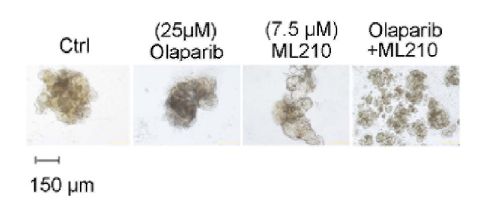

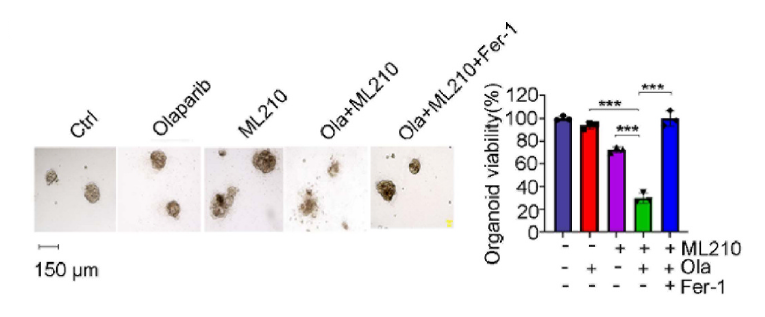
本研究证实了BRCA1缺失导致卵巢癌细胞对铁死亡的抵抗增强,BRCA1通过降解GPX4促进铁死亡,并进一步证实BRCA1是通过RING结构域与GPX4相互作用。文章进一步揭示了BRCA1催化GPX4上的K6多泛素化,并确定了GPX4赖氨酸47和58位点的多泛素化。此外,实验还验证了GPX4在BRCA1缺失的卵巢癌中的关键作用,以及GPX4沉默增强了PARP抑制剂引起的铁死亡。
最后,研究证明了在BRCA1缺失的PDO与PDX模型中,PARPi和GPX4抑制剂的联合治疗具有协同抑制效果。 文章的讨论部分深入探讨了BRCA1在DNA损伤修复和调节氧化应激中的角色,以及PARPi在治疗BRCA1/2突变癌症中的双重机制。本研究提出了一种新的策略,即通过抑制GPX4来优化BRCA1突变癌症患者的PARP抑制剂治疗。



