
文献解读丨复旦大学附属肿瘤医院建立类器官模型揭示铁死亡在胰腺癌治疗中的重要作用
胰腺癌是全球常见的致死性肿瘤之一,大部分患者在确诊时已处于局部进展期甚至发生远处转移,失去了手术机会;而成功接受手术的早期患者,在术后也极易复发转移,预后不佳。作为一种高度侵袭性的恶性肿瘤,胰腺癌的发生发展机制错综复杂,有效治疗手段又严重匮乏,因此新靶点和新治疗策略的开发迫在眉睫。
复旦大学附属肿瘤医院虞先濬教授团队探索了SMAD4这一关键分子在胰腺癌进展中的重要作用,为攻克这一难题带来了新的曙光。
本研究中胰腺癌组织单细胞酶解,胰腺癌类器官建模及扩增,胰腺癌类器官冻存过程中所使用的产品均由科途医学提供。

文献导读:
本研究发现,SMAD4的表达状态几乎完全决定了胰腺癌细胞在TGF-β1刺激下的EMT(上皮间质转化)发生方向与侵袭潜能并且通过转录抑制GPX4(谷胱甘肽过氧化物酶)的表达,使TGF-β1诱导的高侵袭性胰腺癌的铁死亡敏感性增加。
研究人员巧妙地运用这一特性,利用铁死亡诱导剂RSL3,显著增强了吉西他滨的疗效,这无疑为胰腺癌的治疗开辟了新的思路。更令人惊喜的是,这一发现在胰腺癌类器官和小鼠移植瘤模型中得到高度重现,为后续开展临床转化研究奠定了坚实基础。
这项研究的意义不仅在于阐明了SMAD4调控胰腺癌恶性进展的新机制,更在于为SMAD4阳性的胰腺癌患者提供了精准靶向的新靶点和治疗策略。SMAD4-GPX4轴的发现,为深入理解胰腺癌的分子病理提供了新的视角,也为今后开展转化医学研究开辟了新的方向。
研究路线:
为了系统探究SMAD4在胰腺导管腺癌(PDAC)中的作用,研究者们开展了一系列细致的实验。
首先在PDAC细胞系中发现SMAD4在不同细胞系中呈现差异性表达。随后构建了SMAD4过表达和敲除的细胞系,用于后续功能学实验。在探索SMAD4对TGF-β1诱导的EMT影响时,研究者采用了形态学观察、Western blot、Transwell小室侵袭实验、划痕实验等多种评估方法。
结果显示,SMAD4的表达状态决定了PDAC细胞对TGF-β1诱导EMT的响应方向和程度。
为了寻找SMAD4下游的关键分子,研究者进行了RNA测序及生物信息学分析,鉴定出GPX4是一个显著的SMAD4负调控基因。
进一步的qRT-PCR和Western blot实验验证了这一结果。随后研究者通过GPX4启动子的荧光素酶报告基因实验和ChIP-qPCR实验揭示了SMAD4转录抑制GPX4的分子机制。
研究结果:
在探索SMAD4-GPX4轴调控铁死亡敏感性的过程中,研究人员使用了铁死亡特异性荧光探针BODIPY和脂质过氧化产物MDA检测,证实了SMAD4通过抑制GPX4表达,增加PDAC细胞的铁死亡敏感性。
同时还通过CCK-8细胞活力实验和克隆形成实验,评估了SMAD4表达状态对PDAC细胞增殖和存活的影响。最后,GPX4抑制剂RSL3联合吉西他滨可增强对肿瘤的细胞毒作用,以上结果提示SMAD4表达可增强这一联合用药方案的疗效。
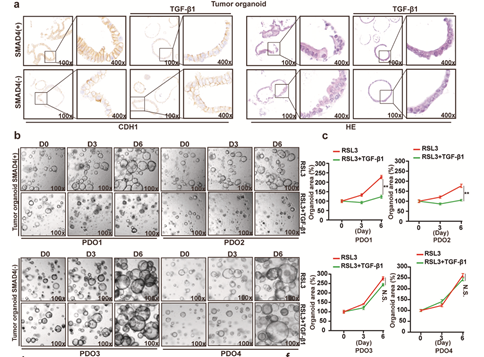
为了进一步探究SMAD4-GPX4轴的体内作用,研究人员还建立了PDAC类器官和小鼠皮下移植瘤模型。
在类器官实验中,Western blot 和qRT-PCR结果显示,SMAD4阳性类器官中EMT诱导更加显著,GPX4表达更低。后续药效学实验证实,SMAD4阳性类器官对RSL3和吉西他滨联合用药的敏感性更高。
在小鼠移植瘤模型中,研究者将不同SMAD4表达状态的PDAC细胞接种于裸鼠皮下,待肿瘤形成后给予RSL3联合吉西他滨治疗,结果表明SMAD4阳性移植瘤生长速度更快,EMT表型更明显,同时对药物治疗的响应也更好。
为了更直观地呈现SMAD4对PDAC细胞铁死亡的影响,研究人员还进行了透射电镜观察:SMAD4敲除细胞中线粒体形态较完整,而过表达SMAD4的细胞线粒体肿胀破裂,提示铁死亡特征。此外,SMAD4表达还影响体内移植瘤中GPX4与EMT相关分子的表达水平,这一结果通过免疫荧光和免疫组化也得到了验证。
最后,研究人员还分析了TCGA数据库中PDAC患者的基因表达谱,结果显示SMAD4 mRNA水平与GPX4呈负相关,与EMT相关基因呈正相关。Gene set enrichment analysis (GSEA) 结果进一步揭示,SMAD4高表达的PDAC样本中,EMT通路和铁死亡通路的富集显著。
内容小结:
综上所述,研究者采用了细胞、动物和临床样本等不同层次的实验模型,运用多种研究方法和分析手段,从机制和功能两个方面系统阐述了SMAD4-GPX4信号轴在PDAC进展中的重要作用。相信这项研究不仅能够加深人们对PDAC这一难治癌症的认识,也为后续开发新型诊疗策略开辟了道路。
在这项研究中,研究人员创新性地应用了类器官技术,为探究SMAD4在胰腺导管腺癌进展中的作用提供了更加贴近临床的实验模型。
总的来说,类器官模型在本研究中发挥了独特而重要的作用。一方面,类器官继承了原代肿瘤组织的生物学特性,高度模拟了人体内肿瘤微环境,使得体外实验结果更具临床指导意义。另一方面,类器官的应用也克服了传统细胞系和动物模型的局限性,为探索PDAC发生发展的分子机制提供了新的技术手段如基因编辑、药物筛选等技术,类器官有望成为开发和评估抗癌新药的理想平台。这项研究中类器官的成功建立和应用,展现了这一前沿技术在癌症精准医学研究中的巨大潜力。


