
肿瘤个性化精准治疗时代,你需要有个“替身”帮你测试多种药物的敏感性
导读
类器官是近年突破发展的一种体外3D组织培养技术,可以在体外高成功率、快速的培养人的组织细胞,形成保留原器官组织结构和生物信息的“微组织”,在个性化治疗和再生医学领域有广泛的应用前景。肿瘤类器官培养技术,通过在体外建立类似体内的微环境,把患者组织分离的肿瘤细胞在体外实现3D培养,形成微型肿瘤模型。利用该模型帮助肿瘤患者个性化的测试多种药物的敏感性,实现个性化的精准医疗。
正文
什么是3D类器官模型
3D类器官模型是一个体外的培养技术,在2017年《NAT METHODS》杂志当中提出肿瘤类器官是突破性的3D干细胞培养技术,不同于以往的2D的培养技术,可以更进一步实现成功率更高的从肿瘤组织个性化的模型。可以测试化疗药物及靶向药物的敏感性,实现个性化用药方案的筛选。
与临床应用药物敏感测试不同的是,它是应用患者肿瘤组织利用3D技术培养后建立器官模型再进行测试药物的敏感性
类器官模型建立后,可以在液氮中长期储存,随时复苏,并进行药物敏感性的测试


类器官模型的培养流程

类器官技术的发展历史
虽然类器官模型这项技术对于患者来讲是个很新的名词,但是它的发展也是通过了很长的一段时间的,当从很早的一些假说开始,专家通过分化比较低的干细胞,在刺激诱导下分化成不同的组织或者器官。直至1987年,一些专家建立了乳腺导管和肺的培养、分离,完成首例人类胚胎干细胞后慢慢的逐步建立不同部位的类器官,直到现在的临床相关性研究。才有了现在我们临床所应用的相对成熟的类器官模型。

同时类器官从组织形态和遗传特性也是高度保留了肿瘤的特性,遗传突变图谱于原肿瘤组织吻合度高达96%。这样才可以保证我们检测出来的药物敏感性以及耐药机制更加符合患者本身个性化情况。

类器官技术在临床实验中的应用
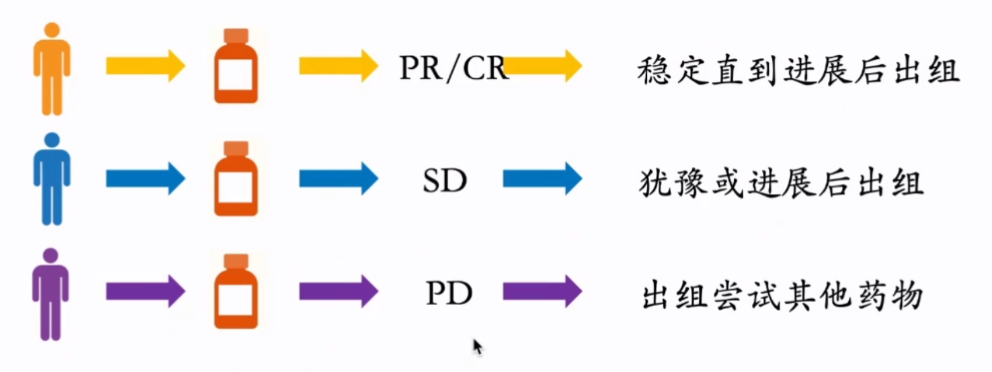
那么患者最关心的可能就是耐药后该何去何从,很多临床实验后耐药后出组的患者,自己吃靶向药耐药后的患者,想知道下一步该怎么办,那么我们就可以通过类器官模型来分析耐药的原因,以及后续用药的选择。
结语




