
胆管癌丨《柳叶刀·肿瘤学》发布针对胆管癌IDH1突变新型靶向疗法获益新数据!
胆管癌(CC)是一种对化疗敏感的罕见且致死率高的恶性肿瘤,晚期转移性胆管癌患者的5年生存率仅有2%。该病的全球发病率正在上升,尽管吉西他滨联合顺铂是目前标准的一线治疗方案,但二线及后线治疗却效果有限,对于胆管癌的治疗,迫切需要新的治疗方案和方法。
胆管癌是一种起源于肝内和肝外(包括肝门周围和胆道远端)不均匀的胆道上皮肿瘤。基因组分析表明,胆管癌存在约40%可作为治疗靶点的基因突变,具有靶向治疗的可能。1
胆管癌靶向治疗中,除了FGFR2基因融合/重排以外,另一个新兴的分子靶点就是IDH1基因突变。IDH1基因突变通过影响肝祖细胞(又称小肝细胞,在肝再生、肝/胆管癌的发生发展中发挥重要的作用)分化和增殖在胆管癌发病机制中发挥作用。3,4
2020年6月21日,《柳叶刀·肿瘤学》(IF=33.752)发表了IDH1抑制剂Ivosidenib在IDH1基因突变且化疗难治胆管癌中的ClarIDHy III期研究结果,与安慰剂相比,Ivosidenib显著提高患者的无进展生存期(PFS),并使先前接受治疗的IDH1突变胆管癌患者的疾病进展或死亡风险降低63%。5

IDH1突变与IDH1抑制剂
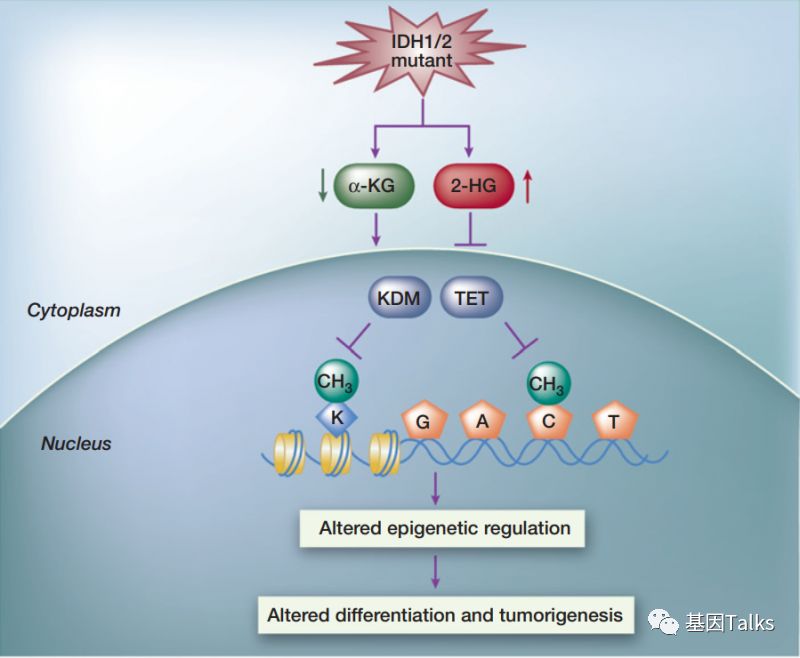
IDH1是人类癌症中代谢基因(metabolic genes)发生突变频率最高的,并干扰细胞新陈代谢和表观遗传调控,从而促进肿瘤发生。
IDH1基因编码的异柠檬酸脱氢酶1是一种代谢酶,正常情况下催化异柠檬酸氧化脱羧成ɑ-酮戊二酸(α-KG)。
当IDH1基因发生突变时(mIDH1),导致异柠檬酸正常氧化脱羧功能丧失,同时获得一个新的催化功能,催化α-KG到2-羟基戊二酸(2-HG)的转化。而2-HG抑制一些表观遗传氧化酶,造成基因表达异常(或细胞能量代谢异常等)而诱发癌症发生。
简言之就是:IDH1突变导致2-HG异常增高,2-HG是一种肿瘤细胞代谢产物,可能在胆管癌的发生中起着重要作用。IDH1抑制剂(Ivosidenib,肿瘤代谢调节药物,一种新型靶向疗法)通过减少致癌代谢物2-HG的异常生成发挥作用,从而导致恶性细胞分化。
胆管癌中IDH1突变频率
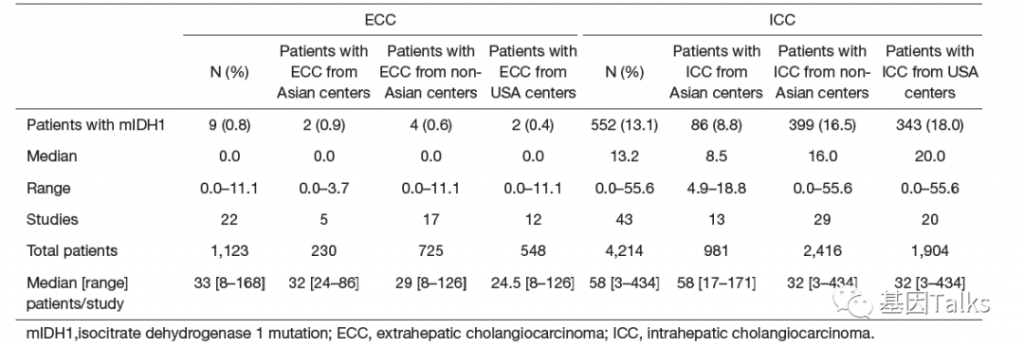
胆管癌(CC)主要分为肝外胆管癌(ECC)和肝内胆管癌(ICC),根据45篇公开发表的 5,393例胆管癌 (4,214例ICC;1,123例ECC及56例解剖位置不明胆管癌)IDH1突变频率数据显示:全球ECC的IDH1突变频率为 0.8%,ICC的IDH1突变频率为 13%,ICC的IDH1突变频率显著高于ECC。3
先看亚洲中心数据:ICC IDH1突变频率显著高于 ECC IDH1突变频率(8.8% vs 0.9%);
再看非亚洲中心数据:ICC IDH1突变频率显著高于 ECC IDH1突变频率(16.5% vs 0.6%);
最后看美国中心数据:ICC IDH1突变频率显著高于 ECC IDH1突变频率(18% vs 0.4%);
ClarIDHy III期研究新数据
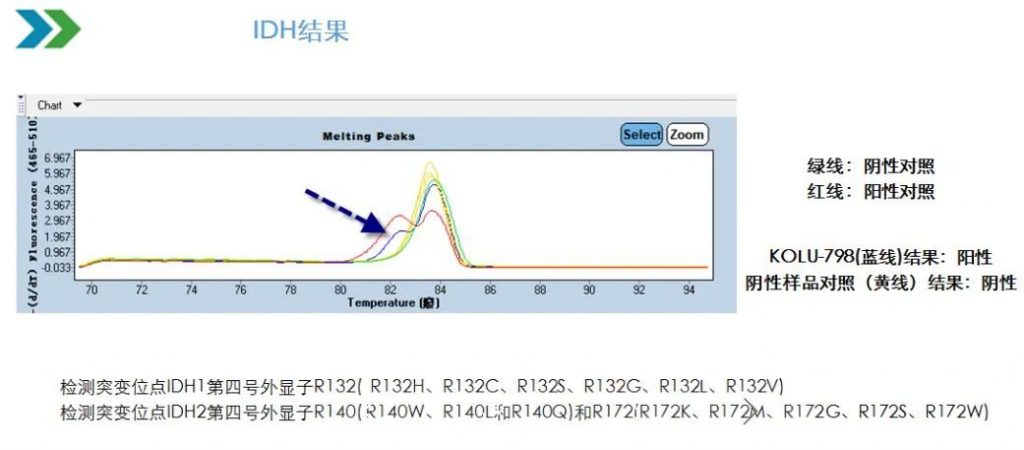
ClarIDHy是国际性,双盲,安慰剂对照,随机III期临床试验,在185例(90~95%是ICC患者)既往接受过治疗且携带IDH1突变的胆管癌患者中比较了(按2:1的比例随机分配)IDH1抑制剂ivosidenib(n=124)和安慰剂(n=61)的效果。
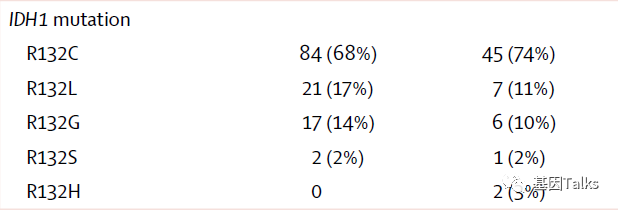
IDH1突变状态的检测是采用Thermo Fisher的NGS产品Oncomine Focus对FFPET(最好是最近3年内存储的肿瘤样本或新鲜肿瘤活检)进行检测。185例患者中R132C是最常见的突变,约占70%,其次是R132L突变,约占15%。
中位随访6.9个月时,ivosidenib组的PFS(主要疗效终点)优于安慰剂组(2.7月 vs 1.4月,HR=0.37),疾病进展或死亡风险降低 63%。6个月(32% vs 22%)和12个月(22% vs 0%)时PFS也优于安慰剂组。
本试验允许安慰剂组患者发生进展后跨组接受ivosidenib治疗,因此ivosidenib组合安慰剂组的中位总生存期相似,分别是 10.8月 和 9.7月。

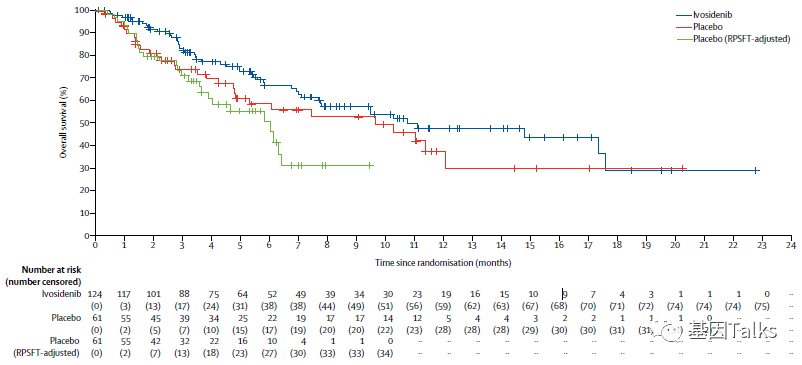
本研究证实了ivosidenib对IDH1突变型胆管癌患者在既往标准化疗中进展的有效性和安全性。Ivosidenib治疗显著改善无进展生存期(PFS),具有良好的安全性和耐受性。这项研究显示了靶向一个分子定义的胆管癌亚群(IDH1突变胆管癌)的可行性和临床效益,并保证肿瘤突变谱作为这一异质性疾病的新治疗标准。
参考资料:
1.Nakamura, H. et al.Genomic spectra of biliary tract cancer. Nat. Genet. 47, 1003–1010 (2015).
2.https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-treatment-patients-cholangiocarcinoma-cancer-bile-ducts
3.Boscoe Audra N,Rolland Catherine,Kelley Robin Kate,Frequency and prognostic significance of isocitrate dehydrogenase 1 mutations in cholangiocarcinoma: a systematic literature review.[J] .J Gastrointest Oncol, 2019, 10: 751-765.
4.Saha Supriya K,Parachoniak Christine A,Ghanta Krishna S et al. Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer.[J] .Nature, 2014, 513: 110-4.
5.Abou-Alfa Ghassan K,Macarulla Teresa,Javle Milind M et al. Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study.[J] .Lancet Oncol., 2020, 21: 796-807.
IDH1/2突变”轻舟-药敏计划”
案例分析
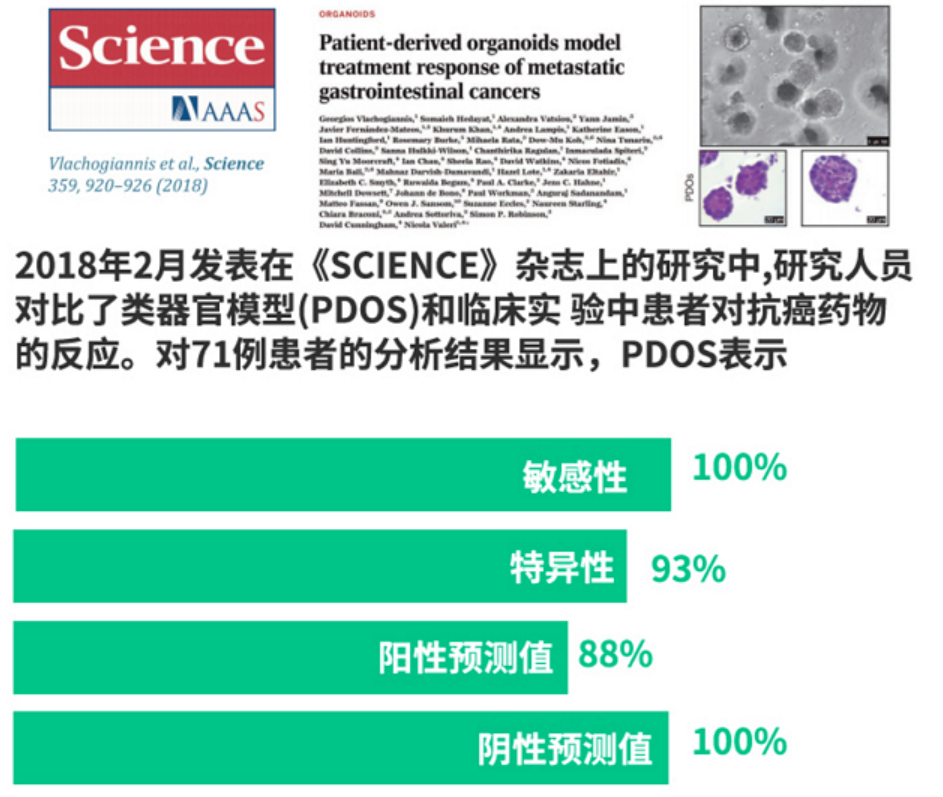
一例59岁 IIIA期肺腺癌患者,多西他赛+顺铂治疗PD,检测有IDH1 R132H突变,并成功建立了类器官模型,对类器官样品进行突变检测,可见明显IDH1突变信号。
IDH1/2突变目前国内暂没有上市的靶向药物,这也是很多IDH1/2突变患者最困惑的问题。长三角肺癌协作组是国内第一个推出类器官培养和筛选援助的协作组,对入组长三角肺癌协作组相关临床试验出现耐药的患者免费进行类器官培养,寻找下一步用药方案并指导治疗。同样欢迎助力于长三角肺癌协作组相关临床试验开展的国内外新药研究机构前来咨询。
什么是类器官培养?
类器官是近年突破发展的一种体外3D组织培养技术,可以在体外高成功率、快速的培养人的组织细胞,形成保留原器官组织结构和生物信息的“微组织”,在个性化治疗和再生医学领域有广泛的应用前景。肿瘤类器官培养技术,通过在体外建立类似体内的微环境,把患者组织分离的肿瘤细胞在体外实现3D培养,形成微型肿瘤模型。利用该模型帮助肿瘤患者个性化的测试多种药物的敏感性,实现个性化的精准医疗。
哪些患者可以免费参加类器官培养?
成功入组长三角肺癌协作组相关临床试验,耐药后出组的患者可免费接受类器官培养,帮助患者寻找下一步用药方案并指导耐药后治疗。
“轻舟计划”少见突变类器官模型药敏临床研究
“轻舟药敏”计划目标是建立各种少见突变的肿瘤类器官模型,入组患者成功建立类器官后,提供免费用药指导报告。
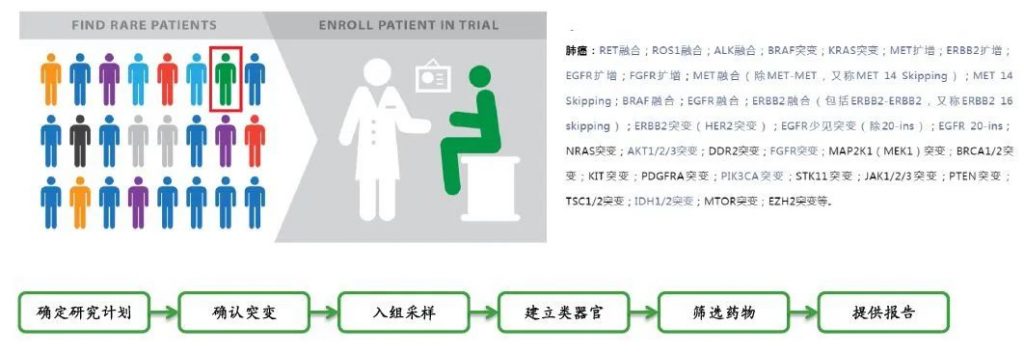
实体瘤:NTRK融合;NRG1融合;FGFR融合;EWSR1融合;TFE3融合;TMPRSS2融合;BAP1融合;MYB融合;MAML2融合;CIC融合;BCOR融合;YWHAE融合;FUS融合;PAX3融合;SYT融合;NR4A3融合;HMGA2融合;EGFR KDD,MET KDD,BRAF KDD,FGFR KDD,ALK KDD,ROS1 KDD,RET KDD,ERBB2 KDD,JAK KDD,KIT KDD,PDGFRA KDD,LYN KDD,SOX17 KDD,NTRK KDD,BAP1 KDD,TMPRSS2 KDD,ERBB4 KDD,VHL KDD,MAP3K1 KDD,RAF1 KDD,AKT3 KDD,CDK8 KDD等。
肺癌:RET融合;ROS1融合;ALK融合;BRAF突变;KRAS突变;MET扩增;ERBB2扩增;EGFR扩增;FGFR扩增;MET融合(除MET-MET,又称MET 14 Skipping);MET 14 Skipping;BRAF融合;EGFR融合;ERBB2融合(包括ERBB2-ERBB2,又称ERBB2 16 skipping);ERBB2突变(HER2突变);EGFR少见突变(除20-ins);EGFR 20-ins;NRAS突变;AKT1/2/3突变;DDR2突变;FGFR突变;MAP2K1(MEK1)突变;BRCA1/2突变;KIT突变;PDGFRA突变;PIK3CA突变;STK11突变;JAK1/2/3突变;PTEN突变;TSC1/2突变;IDH1/2突变;MTOR突变;EZH2突变等。
已建耐药类器官Preclinical Model汇总表
肺癌耐药:一代二代EGFR TKI耐药[继发性MET扩增;继发性HER2扩增(ERBB2扩增);继发性PIK3CA突变,继发性BRAF突变;转小细胞肺癌;上皮间质转化];三代EGFR TKI耐药[继发性MET扩增;继发性HER2扩增(ERBB2扩增);继发性PIK3CA突变,继发性BRAF突变;转小细胞肺癌;上皮间质转化];免疫治疗耐药(单细胞测序)。
临床试验面临的挑战
生物标志物不明确:与药效关联的生物标志物发现;招募困难:特别是少见突变患者少,临床试验推进速度慢。临床试验增加导致患者资源相对稀缺;患者依从性差:疗效达不到预期很容易出组;数据分析困难:对耐药和出组患者的生物学过程理解不充分;费用昂贵,招募规模大。
出组病例分析和耐药患者解决方案

类器官为进展出组患者提供建模筛药:增加入组患者入组意愿和稳定性:及时药物无效,也可能提供获益解决方案;出组患者的类器官用于分析耐药原因,帮助分析和理解临床数据,改善临床研究方案。



