
科途医学肿瘤类器官助力诱导铁死亡化合物发现及机制研究

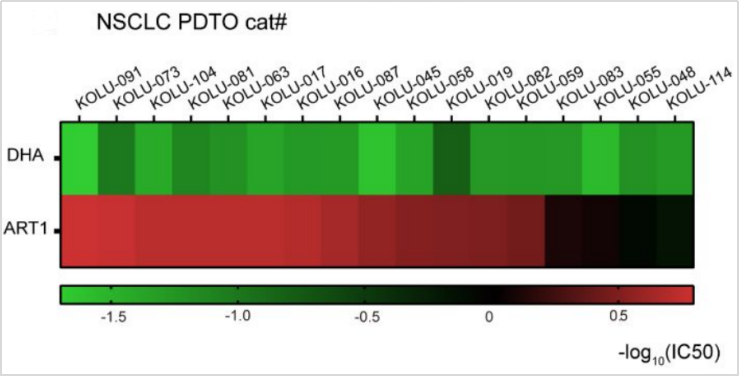
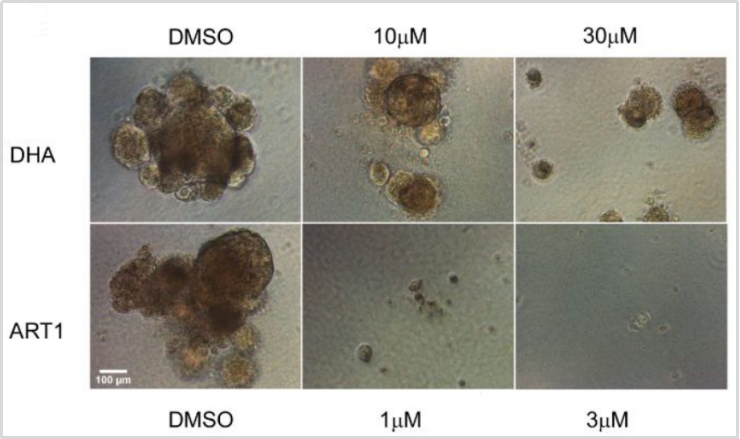
为了验证ART1是否能够抑制原发性癌细胞生长,研究者通过抗增殖效果测试实验,分别使用ART1和DHA(双氢青蒿素)处理由患者衍生的肿瘤类器官,发现ART1对非小细胞肺癌(NSCLC)患者的PDTO生长的抑制率比DHA高10倍以上。
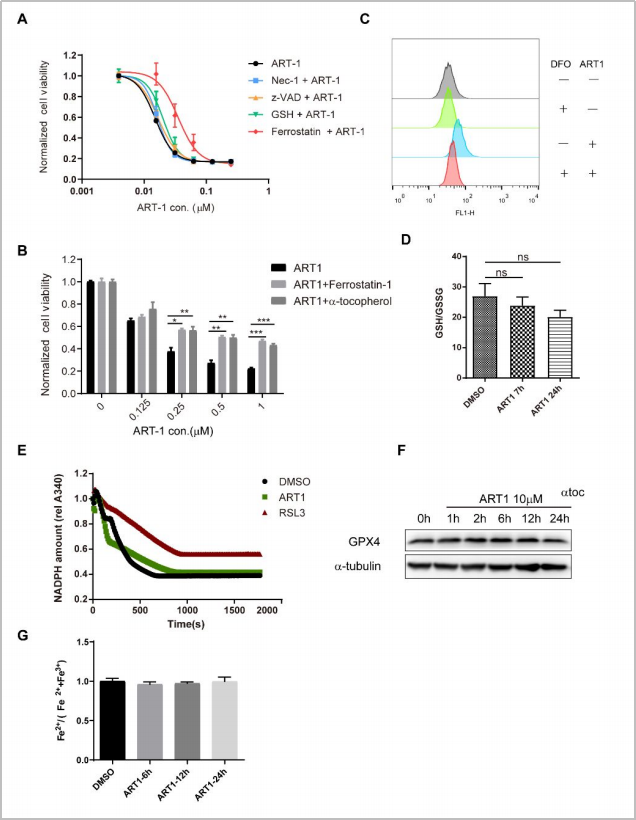
在探究ART1诱导癌细胞死亡的作用机制时,研究者使用不同浓度的ART1或细胞死亡抑制化合物处理MV411细胞,结果显示ART1的致死性仅受可阻碍脂质过氧化物积累的铁死亡抑制剂ferrostatin-1抑制,而不受凋亡抑制剂z-VAD-FMK或necroptosisin-1(Nec-1)1的抑制,表明ART1治疗会引发癌细胞铁死亡。同时检测ART1处理后的细胞内GPX4(铁细胞死亡重要调节因子)活性,发现其的未发生变化,证明ART1与已知铁死亡抑制剂作用机制不同。
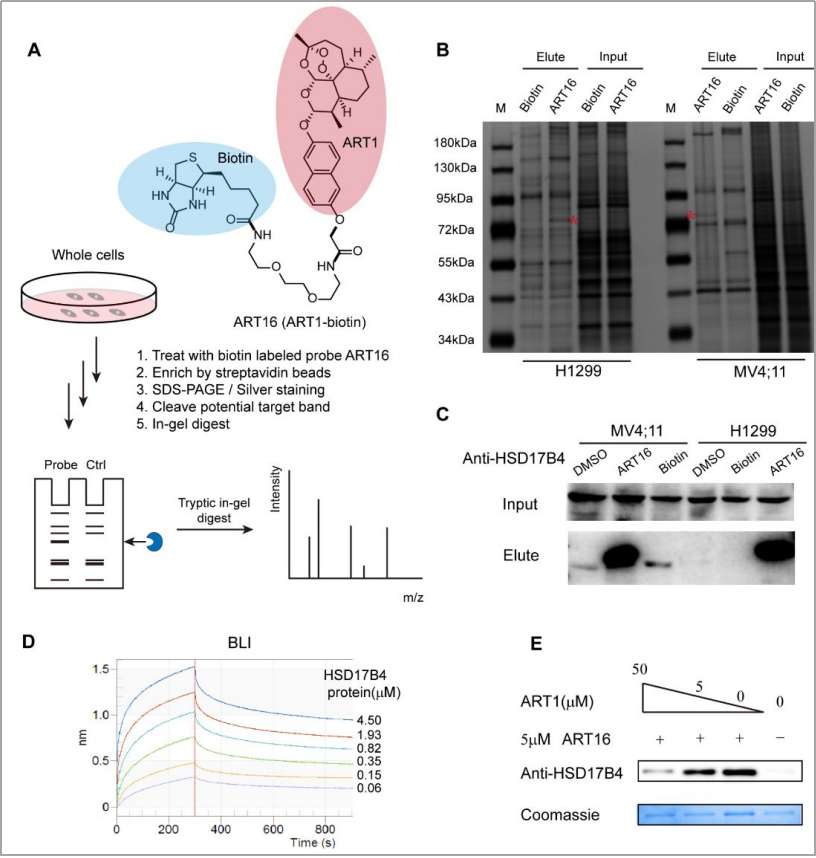
通过将设计、合成的一种生物素标记工具化合物ART16用于研究ART1介导诱导铁死亡的蛋白靶点,并采用质谱分析、蛋白质组学分析和免疫印迹研究等实验证明ART1可选择性地结合HSD17B4蛋白。
知识小讲堂
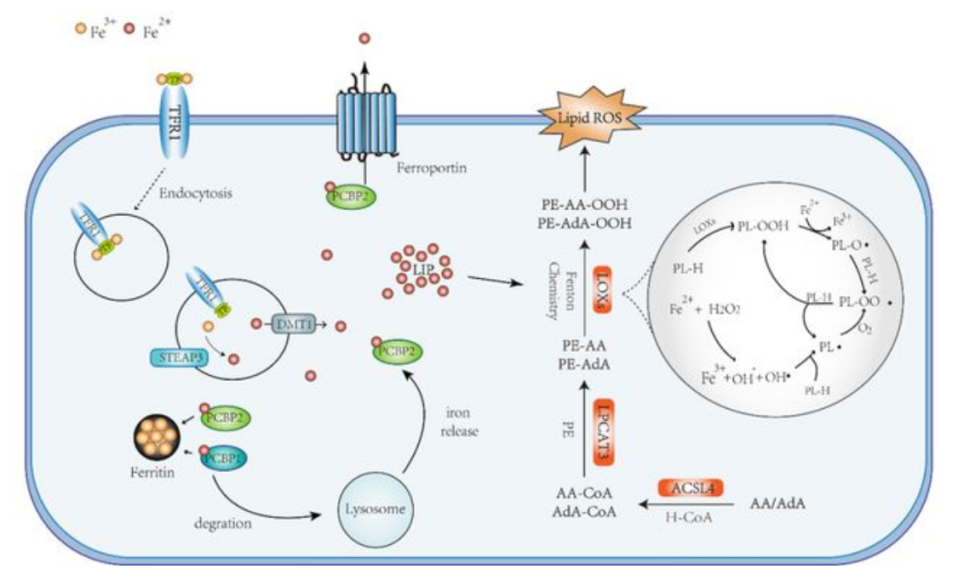
铁死亡(ferroptosis)是一种铁依赖性的调节性细胞死亡形式,由过度的脂质过氧化所引起,它与各种类型肿瘤的发生、和治疗反应均有关。然而,铁死亡性损伤可在肿瘤微环境中触发炎症相关的免疫抑制,从而有利于肿瘤的生长。目前越来越多的临床前证据表明,诱导铁死亡可能是一种有效的治疗策略,可以防止发生对拉帕替尼、厄洛替尼、曲美替尼、达普拉非尼和维莫拉非尼等多种药物的获得性耐药性。一些耐药肿瘤细胞表现出EMT(间质标志物上调和上皮标志物下调)的耐药肿瘤细胞的迹象,结果是,它们对铁死亡更加变得敏感。
更多产品信息可通过公众号查询
欢迎联系我们:




