
科途公开课:类器官技术文章精选|肿瘤类器官与外周血淋巴细胞共培养,产生肿瘤应激性T细胞
Cell:肿瘤类器官与外周血淋巴细胞共培养,产生肿瘤应激性T细胞
2018年诺贝尔生理学或医学奖授予美国免疫学家詹姆斯·艾利森(James Allison)和日本生物学家本庶佑(Tasuku Honjo)后,免疫治疗越来越频繁地走进大众视野,部分患者癌症免疫治疗取得的成果、针对免疫靶点的新药开发爆发成为关注热点。例如,针对免疫检测位点(如CTLA-4和PD-1/PD-L1)的抗体对包括黑色素瘤、非小细胞肺癌(NSCLC)和家族型结肠癌(dMMRCRC)这些类型的晚期患者有明确疗效。但鉴于癌症免疫逃逸机制繁多,如果能开发出可以研究患者个体肿瘤与T细胞之间相互作用及其应答作用决定因素的技术平台,对于探究免疫逃逸机制及寻找有效方法恢复肿瘤对T细胞敏感性,对于肿瘤的免疫治疗有重要意义。
2018年9月,荷兰癌症研究所Dr. Emile E. Voest团队在Cell上发表了一篇题为“通过外周血中淋巴细胞和肿瘤类器官共培养产生肿瘤应激性T细胞”的文章,为公众打开了全新思路。通过建立患者体外肿瘤类器官模型,并与患者外周血淋巴细胞(PBLs)共培养,可获得特异性肿瘤应答T细胞。这一实验方案提供了一种产生肿瘤特异性T细胞的新方法,并为评估个体患者水平上T细胞介导的肿瘤细胞攻击的敏感性提供了无偏系统性分析平台。

同时,研究者还证实此方法产生的T细胞能有效杀死肿瘤类器官而不影响健康类器官存活。实时成像等监测手段提供的数据更表明此平台可用于推测自体T细胞的杀伤速率。此平台为研究不同癌症(新)抗原介导的T细胞杀伤、肿瘤基因表达如何影响T细胞攻击敏感性、如何检测提高这种敏感性提供了重要工具。
在实现个性化医疗的靶向治疗领域,患者个体化模型潜力巨大。文章结尾作者推测,该平台的主要应用有两个方面:第一,类器官平台将在免疫治疗方面提供直观的实验模型,更准确地了解肿瘤细胞的敏感性及耐药性;第二,为获得患者特异性T细胞提供了一种TIL之外的途径。
以下是原文解读:
概述
利用改进的人源肿瘤类器官模型,使外周血来源的T细胞扩增为肿瘤特异性T细胞,并对其抗癌特性进行个体化分析。
文章亮点
外周血淋巴细胞和肿瘤类器官共培养可获得肿瘤应答性T细胞;
此肿瘤应答性T细胞对健康类器官或组织无攻击性;
此平台可用于T细胞介导的肿瘤杀伤效应的评估。
总结
免疫疗法已在部分上皮癌患者中展现出明确的临床疗效。然而,目前仍缺乏能够用于研究患者T细胞与肿瘤之间应答及其决定因素的平台。本研究中,我们成功建立了这样的平台:将家族型结肠癌(林奇综合征)与非小细胞肺癌患者的自体肿瘤类器官与其外周血淋巴细胞共培养获得肿瘤特异性T细胞,而且这些T细胞可有效杀伤其对应的肿瘤类器官。
介绍
针对免疫检测点(如CTLA-4和PD-1/PD-L1)的抗体已在临床显示出对包括黑色素瘤、非小细胞肺癌(NSCLC)、家族型结肠癌(dMMR CRC) 等癌肿的晚期患者的明确疗效,自体肿瘤浸润淋巴细胞(TILs)在黑色素瘤中有显著的临床疗效,在宫颈癌的治疗中其疗效也初见端倪,但仍有一大群患者对现有免疫治疗无效。治疗失败的原因很多,包括免疫抗原数目偏低、抗原呈递缺陷、可替代免疫检测点分子表达量低。鉴于癌症免疫逃逸的机制繁多,目前很难预测单个患者是否对免疫疗法敏感、其产生抗性的机制及何种方法能够逆转这种抗性。
建立个体化的T细胞介导的肿瘤识别、杀伤平台,并对其开展精准、系统的分析,将帮助我们了解抗肿瘤免疫应答过程中的决定性因素。目前的大部分研究都在黑色素瘤中进行,因为有稳定可靠的方法分离和扩增此种癌肿的肿瘤浸润性T细胞(TIL),而且黑色素瘤细胞系的建立也已比较成熟。但随着上皮癌免疫治疗的广泛临床发展和应用,建立研究上皮癌T细胞介导的肿瘤识别平台具有重要意义,但一直以来,建立上皮癌原代肿瘤细胞系(如NSCLC和CRC)的成功率较低(10%或更低) ,获得对应的肿瘤活性T细胞也很困难,使针对上皮癌的免疫治疗研究受阻。
我们针对癌症个体患者,建立了自体T细胞与肿瘤类器官共培养平台。肿瘤类器官是具有三维立体结构的源自原代肿瘤细胞的体外“迷你肿瘤”,它保留了原发肿瘤的组织学与基因特征。通过外科手术切除的肿瘤组织(如CRC类器官建模成功率为60%-90%)或转移瘤的针刺活检(如CRC类器官建模成功率为70%)来建立类器官模型。本项研究中,我们希望解决两个问题:第一,肿瘤应答性T细胞是否可通过外周血淋巴细胞(PBLs)和肿瘤类器官共培养获得;其次,这些T细胞是否可用来评估对肿瘤细胞的杀伤效力。利用外周血淋巴细胞得到肿瘤应答T细胞,可做为TIL的替代途径。我们对这种方法进行了概念性验证。
实验结果
1.家族型结肠癌类器官的特征
家族型结肠癌(dMMR CRC)具有高突变负荷,PD -1抗体疗法有效率高。我们利用手术样本或针刺活检的新鲜肿瘤组织构建肿瘤类器官。病理学家根据错配修复蛋白的表达情况,按照诊断标准进行病理诊断,与Weeber等研究者的数据一致,类器官建模成功率达60%。建模成功后,每1~2周进行传代,传代比例为1:2~1:5,2~9周内的类器官细胞进行冻存长期保存,冻存的细胞可复苏并扩增。
我们从13位患者建立了15例dMMR CRC肿瘤类器官。这些类器官从形态学上与原肿瘤组织一致。全外显子基因测序显示其高基因突变(非同义突变为795~2,877,中位数 1,938),与之前报道的高突变大肠癌符合。与高突变大肠癌相关性极强的突变点也出现在这些类器官中。考虑到在dMMR CRC中MHC I的丢失率高达60%,我们筛选了建模成功的类器官在干扰素g刺激后MHC I抗原的表达,从8例患者(占类器官样本62%)中确定了9例MHC- I表达阳性的肿瘤类器官。免疫组化显示,肿瘤类器官中MHC I类的表达量与原肿瘤MHC I类表达量相关(相关系数r = 0.78; p = 0.01) ,而且,MHC I类缺失的肿瘤类器官往往来源于MHC I类缺失的肿瘤,这说明MHC I类缺失并不是肿瘤类器官的普遍特征。
2.循环T细胞与自体肿瘤类器官共培养后,T细胞对肿瘤产生应答
我们选择MHC I表达阳性的肿瘤类器官与外周血T细胞。在共培养前,用IFNg刺激肿瘤类器官以增强其抗原表达,同时,IFNg也会诱导T细胞活化的负调控因子PD-L1的表达。为中和PD-L1在T细胞活化过程中的抑制作用,我们加入了PD-L1抗体,同时也加入了血小板粘附的CD28抗体增强共刺激效应及白介素-2 (IL-2)以增强T细胞增殖。从dMMR CRC患者中分离得到外周血单核细胞(PBMCs),每周用自体肿瘤类器官刺激。分别在基线水平下及共培养2周后,通过IFNg和CD107a(淋巴细胞脱颗粒标志物)染色,评价CD8+T细胞对肿瘤的识别杀伤能力。
8例患者中有4例MHC I阳性患者共培养2周后,自体肿瘤类器官可诱导CD8+T细胞分泌IFNg、上调CD107a表达。在MHC I类缺失的患者中无此变化(数据未展示)。T细胞对肿瘤类器官的应答幅度因患者而异,有应答幅度小但可重复(1% – 3%CD8+ T细胞有应答),也有应答幅度大(有近50%的CD8+ T细胞中有应答)的情形。患者CRC-9的T细胞在共培养前即具有肿瘤应答性,在与类器官共培养2周后其应答率增加了近10倍,相比之下,患者CRC-11、CRC-12与CRC-13的T细胞在类器官共培养前未表现出任何可检测到的肿瘤应答性,说明共培养系统也可用于扩增之前无肿瘤应答性的T细胞群。
3.NSCLC患者循环T细胞对肿瘤的应答性
我们进一步验证了此实验方案,即通过从外周血中获得、类器官共培养的肿瘤应答性T细胞是否也适用于非小细胞肺癌(NSCLC)。与dMMR CRC相比,NSCLC的突变量降低约5倍,大约只有约20%的患者对PD-1/PD-L1抗体有效。我们通过与建立CRC类器官相似的方法培养得到6名NSCLC患者的类器官。其中,患者NSCLC-3同时建立了正常呼吸道上皮类器官与肺癌肿瘤类器官,前者生长为囊性薄壁类器官,后者表现为实性形态。我们使用MDM-2抑制剂Nutlin-3a选择性地培养了p53突变细胞,得到排除正常组织的肺癌肿瘤类器官。所有NSCLC 类器官均为MHC I类表达阳性,在IFNg刺激后可表达不同水平的PD-L1。将上述患者的PBMCs与自体肿瘤类器官共培养2周后有2例患者出现肿瘤应答性CD8+T细胞扩增。与dMMR CRC不同的是,在与类器官共培养之前,T细胞并没有肿瘤应答性。以上这些数据表明,在肠道与肺的两种上皮癌中,PBMCs与自体肿瘤类器官共培养可诱导产生特异性肿瘤应答T细胞。
4.类器官应答性T细胞的反应特异性
IFNg增强抗原加工和表达的同时,也诱导大量基因的表达,而这些基因的表达可能引起T细胞应答。为了验证共培养诱导产生的T细胞的肿瘤应答是肿瘤特异性的还是共培养及IFNg刺激产生的非特异反应。我们检测了T细胞活化标志物CD137的表达:一组预先用IFNg刺激,另一组未处理。在5例中有4例CD8+T细胞的肿瘤应答性与IFNg刺激无关。为了进一步证明,我们还检测了自体正常组织类器官及肿瘤类器官消化物是否可诱导肿瘤应答T细胞的产生。我们构建了两名患者(CRC-12与NSCLC-3)的正常结肠和肺的类器官模型。此外,我们也取得了患者CRC-13 (dMMR CRC)的正常(pMMR CRC)、异常肠道组织并分别建立类器官模型。结果显示肿瘤类器官与PBLs共培养2周后可诱导肿瘤应答性T细胞产生,而正常组织类器官及pMMR CRC类器官不能诱导产生肿瘤应答性T细胞。
其中的2例患者采用经消化后的体肿瘤组织单个细胞来刺激产生肿瘤应答性T细胞。对NSCLC-3类器官有应答的T细胞对消化后的肿瘤单细胞也有应答,但对正常肺组织类器官无应答。相反,对NSCLC-1类器官有应答的T细胞对自体肿瘤消化后单个细胞无应答,我们分析,NSCLC-1类器官共培养产生的T细胞因其反应水平相对较低,因此对消化的肿瘤产物的应答能力也低到检测不到,但也尚不能排除本样本中的T细胞反应是针对类器官特异性靶点的反应。结合对照样本结果,结论是:4个样品中有3个CD8+T细胞的应答是肿瘤特异性的。本实验还提示,正常组织类器官可以做为实验对照。
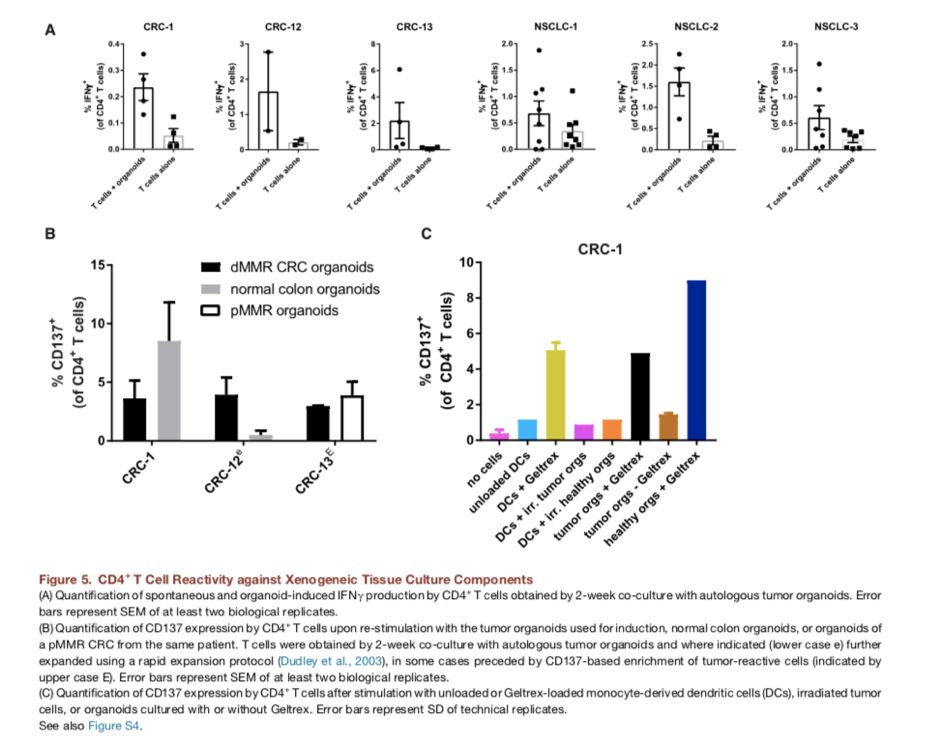
5.CD4+ T细胞对肿瘤类器官的应答
除了肿瘤应答CD8+ T细胞,我们还观察了CD4+T细胞对肿瘤类器官的应答:CD4+T细胞的应答为非特异性,其可以对正常组织类器官(来自患者CRC-13的正常组织的类器官或同期的pMMR CRC的类器官)产生应答。CD4+T细胞可以对正常组织产生交叉反应,而CD8+T细胞则无此种交叉反应,因此我们推测这可能是外环境的外来抗原引发的。因为类器官培养于小鼠基底膜基质(Geltrex)中,小鼠抗原可以被呈递给T细胞。为了证明这一假想,我们将患者CRC-1的外周血单核细胞来源的树突状细胞加入小鼠基底膜基质、辐照的肿瘤细胞、健康结肠类器官,结果显示Geltrex中的树突状细胞或生长在Geltrex中的类器官可以刺激CD4+T产生应答。而且,如果将类器官培养物中的Geltrex去掉,3天后CD4+T的应答基本消失,表明包含Geltrex条件的共培养系统可以诱导CD4+ T细胞产生应答,而不是由肿瘤抗原诱导。最近也有报道,采用合成基质代替Geltrex,可以排除动物源性免疫反应。
6.自体肿瘤应答性T细胞对肿瘤类器官的杀伤
我们已证实在部分患者可通过诱导产生自体肿瘤应答性CD8+ T细胞,接下来,我们来验证类器官系统是否可以用来评估这些T细胞对肿瘤的杀伤效力。我们将肿瘤器官与自体肿瘤应答T细胞共培养3天,采用流式细胞术来定量活肿瘤细胞数,结果显示T细胞可以导致肿瘤细胞生存率大幅下降。加入MHC I类抗体可以挽救肿瘤细胞存活率,说明CD8+T细胞的杀伤为MHC I抗原特异性。用示踪染料标记患者NSCLC-1类器官,并绿色荧光探针标记有活性的caspase-3/7观察肿瘤细胞凋亡,结果显示:自体T细胞的加入导致类器官体积缩小并伴有广泛的细胞凋亡。
为进一步证实自体T细胞对肿瘤细胞的特异性杀伤作用,我们对NSCLC-3患者的肿瘤和健康类器官进行了平行实验。T细胞扩增后,能有效杀死肿瘤类器官,但不影响健康类器官的存活。实时成像显示自体T细胞对肿瘤类器官的强力杀伤作用,而未与T细胞共同孵育的肿瘤类器官与添加了MHC I类和MHC II类抗体的肿瘤类器官仍然保持增殖,而且,健康组织类器官与T细胞孵育后也继续增殖。综上所述,上皮肿瘤的类器官可以用来评估自体T细胞的杀伤效力。这个平台可以做为一个有效工具来评估不同的癌症(新)抗原对T细胞杀伤效应的介导作用及肿瘤细胞基因表达水平如何影响肿瘤对T细胞的敏感性,并且评估提高这种敏感性的方法。
讨论
人类白细胞抗原(HLA)和T细胞-受体(TCR)基因多样性强、T细胞介导的肿瘤杀伤具有多种特性、人类肿瘤新抗原多样性强,因此,要想实现真正的个性化医疗,必须建立个体化、特异性模型,尤其是在肿瘤免疫治疗领域。目前对T细胞的肿瘤识别作用的认识大多建立在黑色素瘤研究的基础上,在上皮癌中,还没有一个完善的系统可以开展个体化的T细胞与肿瘤交互作用的研究。本研究中,我们验证了肿瘤类器官可作为个体化体外模型,进行T细胞与肿瘤细胞相互作用的研究并开展细胞治疗。
此平台有两个主要应用方向:第一,开展肿瘤细胞免疫治疗敏感性与耐药性机制的研究。第二,通过共培养获得患者特异性肿瘤应答T细胞。此平台利用穿刺活检从患者取得肿瘤组织,并从其外周血中取得循环T细胞并将其扩增为肿瘤特异性T细胞。做为一种微创方式,还可以实现在不同时间点取材,进行肿瘤免疫治疗敏感性研究。对于最初对免疫靶点抑制剂治疗有效但后期复发的患者,通过在复发前后分别取材(包括血液、肿瘤组织)建立类器官与外周血T淋巴细胞共培养体系,来研究复发机制。最近,对一小群PD1 治疗后复发的黑色素瘤患者,用此方法建共培养体系并进行基因研究,发现JAK1/2突变是产生耐药性的一个原因(Zaretsky et al.,2016)。那么在上皮癌中是否也存在因JAK1/2突变而造成T细胞攻击敏感性降低,值得研究。此平台除可用于研究肿瘤细胞原发、继发耐药外,还可用于研究小分子、抗体是否可增强肿瘤细胞对T细胞敏感性。在共培养体系中加入药物观察其疗效,做为一个直观的体系,可以帮助筛选有效药物,结合免疫治疗进行肿瘤治疗。该平台的第二种应用,即通过将循环T细胞与肿瘤类器官共培养扩增得到肿瘤应答性T细胞,是一种有效的临床获取患者特异性T细胞的手段。这种方法不需从手术肿瘤样本中提取分离肿瘤浸润淋巴细胞。在我们的概念验证研究中,13例dMMR CRC患者中有4例(31%)用此方法得到肿瘤应答性CD8+ T细胞;6例NSCLC患者中有2例(33%)用此方法得到肿瘤应答性CD8+ T细胞。在MHC I类表达阳性dMMR CRC患者中,有50%可诱导产生肿瘤应答性T细胞,说明可以通过逆转或避免MHC I缺失来解决肿瘤的免疫逃逸,当然这还需要更多样本的研究。在本研究中,我们选取的样本具高突变负荷,这种方法是否也适用于免疫原性差的癌症如pMMR CRC还需研究。与此同时,通过提高循环T细胞的挑选质量如T细胞PD-1的表达,可增加此方法的成功率。
参考文献:
Dijkstra, K. K., Cattaneo, C. M., Weeber, F., Chalabi, M., van de Haar, J., Fanchi, L. F., … Voest, E. E. (2018). Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids. Cell. doi:10.1016/j.cell.2018.07.009
·END·




