
肿瘤类器官药物协同效应测试服务
关于药物协同效应
多个药物联合使用时临床实践中通常方案,多种药物会产生相互影响的效应,可能是“叠加效应”、“拮抗效应”或者“协同效应”。协同效应可能降低药物使用的浓度,提高临床疗效,扩大药效-毒性浓度区间(治疗浓度窗口)。
药物协同效应是指两种或两种以上药物联合使用时,产生的效应超过其各自单独作用所产生的效应之和,及所谓“1+1>2”的现象。产生药物协同效应的原因较多,例如药物-药物相互作用(DDI)产生代谢影响,细胞分子层面产生协同致死等。
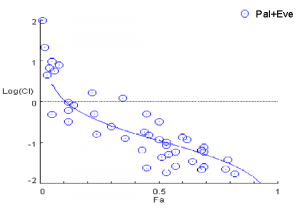
如何在体外评价药物的协同效应可以在体外模型中进行部分测试,例如在细胞模型中测试药物的协同效应。广泛使用的是用协同效应因子(combinationindex,CI)评价药物的协同效应,协同效应时CI<1,叠加效应时CI=1,拮抗作用时CI>1。(1)
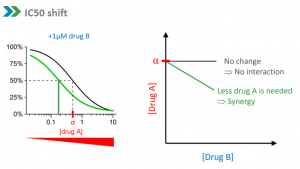
用协同效应因子评价药物联合作用图1,图2
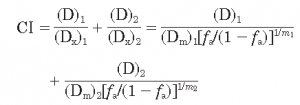
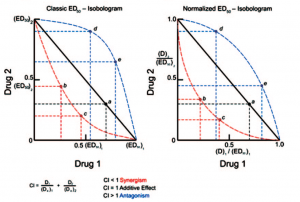
关于科途医学肿瘤类器官模型
1.1肿瘤类器官模型
人源肿瘤类器官(PDTO)模型技术是肿瘤精准医疗的前沿技术,类器官培养是一种体外三维培养技术。可以在体外培养患者的肿瘤细胞,肿瘤细胞被培养在一个三维生长介质中,加入特定的生长因子和细胞外基质用以模拟体内的微环境和维持特定的信号通路,形成保留原器官组织结构和生物信息的“微组织”,细胞在这种环境下自组装成具有类似体内器官组织结构的类器官。类器官技术由于其在再生医学、精准医疗、新药研发和基础研究中的重大意义,2018年初被《NatureMethods》评为“2017年度技术”(Methodof the Year 2017: Organoids)。(2-7)
人源肿瘤类器官模型是肿瘤功能性药物敏感性检测的核心技术方向。肿瘤功能性检测是继基因测序之后,肿瘤精准医学的下一个发展热点。不同于基因检测,肿瘤类器官功能性检测可以从“活细胞”的角度回答个性化用药敏感性问题,具有更好的疾病和临床相关性。
2017年《Cancerdiscovery》报道了在EnglanderInstitute for PrecisionMedicine研究团队开展的一项招募了769名肿瘤患者的临床试验结果,研究者建立了56例PDTO和19例PDTO建立的PDX模型。推断对这些患者进行WES测序,发现单独基因组数据不能有效的帮助大部分患者找到有效的治疗方案,而借助类器官功能性检测,实现大范围的药物筛选,可以帮助患者实现临床获益。文章报道几例子宫和结肠恶性肿瘤,通过类器官模型,找到有效治疗药物的案例。(8)
2018年《Science》报道了伦敦癌症研究所GeorgeVlachogiannis研究团队在转移性结肠癌和胃肠道肿瘤中开展的一项临床试验结果。结果发现,PDTO的表型和基因型分析表示它们和原发性肿瘤的高度相似。科研团队对比了PDTO和临床实验中患者对抗癌药物的反应。在71例患者的研究数据中,PDTO检测表现出100%的敏感性,93%的特异性,88%的阳性预测准确率和100%的阴性预测准确率。研究者还发现,对于不同疾病进展阶段分别获取的肿瘤穿刺,所建立的PDTO,对药物的敏感性伴随对应临床治疗过程而变化,和临床过程同步演化。同时,PDTO也体现了部分患者的肿瘤内异质性。(9)
1.2科途医学ViaBankTM新药研发模型
由于肿瘤类器官模型保留了很多肿瘤组织原有的疾病特征、遗传特征和药效学特征。用肿瘤类器官模型评价药物要比传统的细胞系模型更好的反应中药物的药效。(10)
科途医学活肿瘤类器官标本库具有丰富的人群多样性,模拟患病人群对药物的响应。活细胞新药筛选平台可以筛选新的抗癌化疗药物、靶向药物、生物药物和中药天然化合物。在药物研发早期发现具有临床开发价值的潜在候选药物。对于已经临床获批的药物,具有人群多样性和疾病多样性的类器官标本库用于发现潜在的新适应症。(图2)
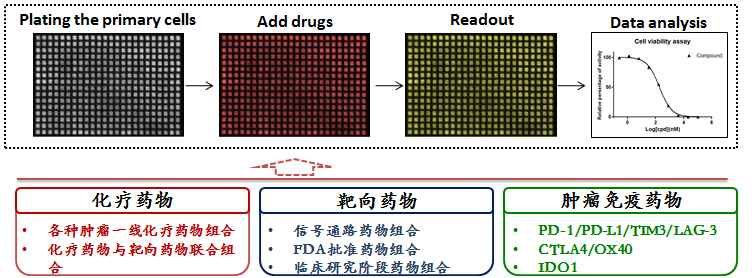
1.3肿瘤类器官联合用药研究(正交试验)
类似于在细胞系上的研究,类器官可以在体外实现高效的药物测试和联合用药评价。科途医学通过正交药物浓度测试,计算药物的协同效应因子(CI),评价协同效应。
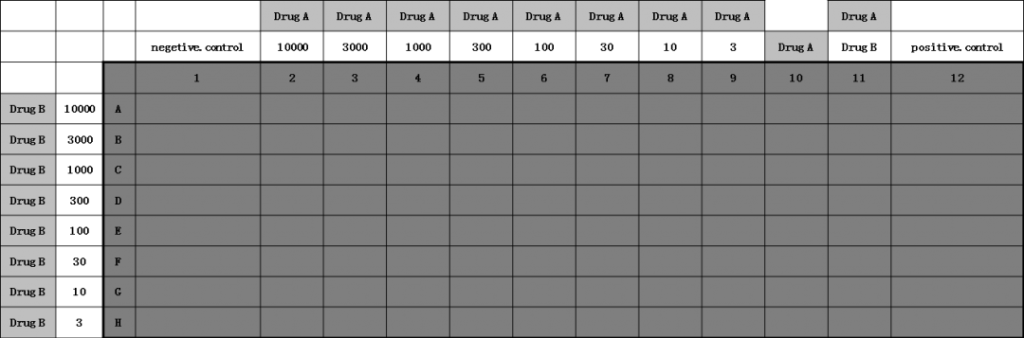
科途医学肿瘤类器官模型 评价药物协同效应试验步骤
2.1单药测试
药物协同效应是在某些特定的浓度区间才能体现,过高的药物浓度或者过低的药物浓度都无法评价药物的协同效应。因此,需要对受试单药进行细致的药效评价。
肿瘤类器官来自某个特定患者个体。不同患者个体对药物的药效存在个体差异,因此对每个肿瘤类器官模型,都需要单独研究起对受试药物的药效。
通过在特定肿瘤类器官模型的药效测试,可以确定IC50,为2药联用提供浓度设定依据。
单药药物测试方案是在96孔细胞培养板中,在每个孔中建立均质的肿瘤类器官,在类器官形成后,加入梯度稀释的受试药物,培养3-5天后,加入CTG,采集化学发光信号,拟合药效计量曲线,计算半抑制浓度,IC50A和IC50B。
2.2两种药物联合测试方法
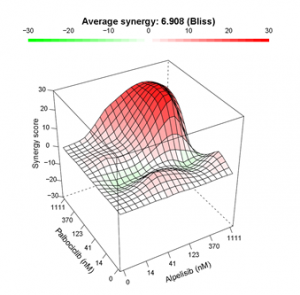
根据2.1试验得到的抑制率,设定测试浓度范围,按照图3中的方式种植构建肿瘤类器官测试板。梯度稀释的正交加入2种药物,药物处理3-5天后,加入CTG,采集化学发光数据,通过软件计算协同效应因子,IC50减少和Bliss热图。
参考文献:
[1]Chou, T. C. (2006) Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological reviews 58, 621-681
[2]Sachs, N., de Ligt, J., Kopper, O., Gogola, E., Bounova, G., Weeber, F., Balgobind, A. V., Wind, K., Gracanin, A., Begthel, H., Korving, J., van Boxtel, R., Duarte, A. A., Lelieveld, D., van Hoeck, A., Ernst, R. F., Blokzijl, F., Nijman, I. J., Hoogstraat, M., van de Ven, M., Egan, D. A., Zinzalla, V., Moll, J., Boj, S. F., Voest, E. E., Wessels, L., van Diest, P. J., Rottenberg, S., Vries, R. G. J., Cuppen, E., and Clevers, H. (2018) A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell 172, 373-386 e310
[3]Walsh, A. J., Cook, R. S., and Skala, M. C. (2017) Functional Optical Imaging of Primary Human Tumor Organoids: Development of a Personalized Drug Screen. Journal of nuclear medicine : official publication, Society of Nuclear Medicine 58, 1367-1372
[4]Weeber, F., van de Wetering, M., Hoogstraat, M., Dijkstra, K. K., Krijgsman, O., Kuilman, T., Gadellaa-van Hooijdonk, C. G., van der Velden, D. L., Peeper, D. S., Cuppen, E. P., Vries, R. G., Clevers, H., and Voest, E. E. (2015) Preserved genetic diversity in organoids cultured from biopsies of human colorectal cancer metastases. Proceedings of the National Academy of Sciences of the United States of America 112, 13308-13311
[5]Friedman, A. A., Letai, A., Fisher, D. E., and Flaherty, K. T. (2015) Precision medicine for cancer with next-generation functional diagnostics. Nature reviews. Cancer 15, 747-756
[6]Duarte, A. A., Gogola, E., Sachs, N., Barazas, M., Annunziato, S., J, R. d. R., Velds, A., Blatter, S., Houthuijzen, J. M., van de Ven, M., Clevers, H., Borst, P., Jonkers, J., and Rottenberg, S. (2018) BRCA-deficient mouse mammary tumor organoids to study cancer-drug resistance. Nature methods 15, 134-140
[7]Rios, A. C., and Clevers, H. (2018) Imaging organoids: a bright future ahead. Nature methods 15, 24-26
[8]Pauli, C., Hopkins, B. D., Prandi, D., Shaw, R., Fedrizzi, T., Sboner, A., Sailer, V., Augello, M., Puca, L., Rosati, R., McNary, T. J., Churakova, Y., Cheung, C., Triscott, J., Pisapia, D., Rao, R., Mosquera, J. M., Robinson, B., Faltas, B. M., Emerling, B. E., Gadi, V. K., Bernard, B., Elemento, O., Beltran, H., Demichelis, F., Kemp, C. J., Grandori, C., Cantley, L. C., and Rubin, M. A. (2017) Personalized In Vitro and In Vivo Cancer Models to Guide Precision Medicine. Cancer discovery 7, 462-477
[9]Vlachogiannis, G., Hedayat, S., Vatsiou, A., Jamin, Y., Fernandez-Mateos, J., Khan, K., Lampis, A., Eason, K., Huntingford, I., Burke, R., Rata, M., Koh, D. M., Tunariu, N., Collins, D., Hulkki-Wilson, S., Ragulan, C., Spiteri, I., Moorcraft, S. Y., Chau, I., Rao, S., Watkins, D., Fotiadis, N., Bali, M., Darvish-Damavandi, M., Lote, H., Eltahir, Z., Smyth, E. C., Begum, R., Clarke, P. A., Hahne, J. C., Dowsett, M., de Bono, J., Workman, P., Sadanandam, A., Fassan, M., Sansom, O. J., Eccles, S., Starling, N., Braconi, C., Sottoriva, A., Robinson, S. P., Cunningham, D., and Valeri, N. (2018) Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science 359, 920-926
更多产品信息可通过公众号查询
欢迎联系我们:




